1、填空题 硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO?B2O3?H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
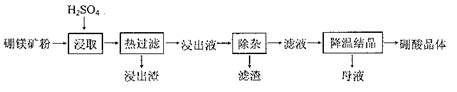
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为?。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是?。H2O2的作用是??(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是?。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4?H2O,应采取的措施是将“母液”蒸发浓缩,?。

参考答案:32.(16分)
(1)CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑?(3分)
(2)Fe3+、Fe2+、Al3+?(3分,每个1分)
H2O2+2H++2Fe2+=2Fe3++2H2O?(3分)
(3)防止温度下降时H3BO3从溶液中析出(意思相同即可给分。例如:从H3BO3溶解度数据可知,温度较高时,H3BO3溶解度较大,不易从溶液中析出。)?(3分)
(4)加压升温结晶?(4分,加压、升温结晶各2分)
本题解析:(1)由于硫酸的酸性比碳酸强,则矿粉中的碳酸钙与加入的稀硫酸能发生复分解反应,生成硫酸钙、二氧化碳气体和水,即CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑,粉末状碳酸钙及分批加入稀硫酸能加快反应速率、防止微溶的硫酸钙覆盖在碳酸钙固体表面阻止反应的顺利进行;根据流程图及题意可知,浸取时2MgO?B2O3?H2O及少量Fe3O4、CaCO3、Al2O3都能溶于稀硫酸,而SiO2不能溶于稀硫酸;(2)双氧水是常用的绿色氧化剂,所含氧元素由—1价降低为—2价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,即H2O2+2H++2Fe2+=2Fe3++2H2O;由于铁离子和铝离子能够水解,即Fe3++3H2O Fe(OH)3+3H+、Al3++3H2O
Fe(OH)3+3H+、Al3++3H2O Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4?H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4?7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4?H2O晶体。
本题难度:困难
2、选择题 为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.乙醇与汽油组成元素相同,化学成分相似
C.乙醇汽油燃烧时,耗氧量高于等质量的汽油
D.乙醇可通过淀粉转化制得,是一种可再生的燃料
参考答案:D
本题解析:略
本题难度:简单
3、填空题 海水占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。也可以电解熔融氯化钠制得钠和氯气,该反应方程式为________________________。
(2)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
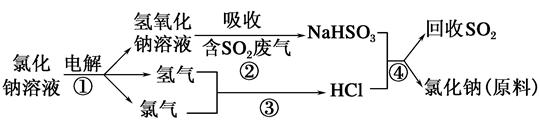
试写出反应的化学方程式:
②__________,③__________,④__________。
参考答案:(1)2NaCl(熔融)  2Na+Cl2↑
2Na+Cl2↑
(2)②NaOH+SO2=NaHSO3
③H2+Cl2 2HCl
2HCl
④NaHSO3+HCl=NaCl+SO2↑+H2O
本题解析:(1)电解熔融NaCl的方程式为2NaCl(熔融)  2Na+Cl2↑。
2Na+Cl2↑。
(2)该流程较清晰地展示了氯碱产品及NaCl循环治理含SO2的废气并回收SO2的原理,根据要求写出方程式即可。
本题难度:一般
4、选择题 利用海水不能制取的物质是
A.NaCl
B.Br2
C.CH2=CH2
D.I2
参考答案:C
本题解析:考查海水资源的开发利用。答案选C。
本题难度:简单
5、填空题 请仔细阅读下列文字,然后回答有关问题。
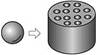
(1)煤是一种常用的化石燃料。家庭用煤经过了从“煤球”到“蜂窝煤”的变化。以前人们把煤粉加工成略大于乒乓球的球体,后来人们把煤粉加工成圆柱体,并在圆柱体内打上一些孔(如上图)。请你分析这种变化的优点是 ______________。
煤在燃烧时会产生许多污染物,为了减少煤燃烧时对环境的污染,可设法把煤转化成清洁的燃料。将水蒸气通过炽热的煤层可制得较洁净的水煤气(主要成分是CO和H2),请你写出该反应的化学方程式。煤气厂常在家用水煤气中特意掺人少量有难闻气味的气体,其目的是?。
(2)某同学在实验过程中发现氢氧化钠固体露置在空气中一段时间后,发生了潮解,他在家中也曾发现过饼干受潮会变软。这些现象说明了空气中含有。请你结合生活经验或化学知识另举两例说明空气中含有这种物质:①、___________?②、___________
参考答案:(1)使煤与空气的接触面积增大,燃烧更为充分C+H2O CO+H2,便于及早发现煤气是否泄漏
CO+H2,便于及早发现煤气是否泄漏
本题解析:“煤球”便为“蜂窝煤”,增加了可燃物与空气的接触面积,是燃烧更快、更充分、更旺;由于水煤气中有一氧化碳,会使人中度,且一氧化碳无色无味,人很难发现它泄漏,所以在煤气中掺人少量有难闻气味的气体就能使人们及时发现,而不至于出现煤气中毒事故。
本题难度:简单