1、填空题 运送“神舟”五号飞船的火箭燃料除液态双氧水外,还有一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子式为___________________________ 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式______________________________________________________ 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式_________________________________________ 。
参考答案:(1)
(2)N2H4+2H2O2=N2+4H2O
(3)N2H4+2HCl=N2H6Cl2
本题解析:
本题难度:一般
2、选择题 金属钠着火时,能用来灭火的是
[? ]
A.水?
B.湿抹布
C.泡沫灭火器?
D.干沙
参考答案:D
本题解析:
本题难度:简单
3、简答题 将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
参考答案:A.因钠很活泼,易被氧化,则金属钠在空气中易氧化形成氧化钠,出现变暗现象,故A正确;
B.氧化钠与空气中的水反应生成氢氧化钠,氢氧化钠吸收空气中的水蒸气在表面形成了溶液,可观察到“出汗”,故B正确;
C.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成白色粉末为碳酸钠,故C正确;
D.整个过程中只有Na→Na2O的过程中有元素的化合价变化,属于氧化还原反应,其余均不是氧化还原反应,故D错误;
故选D.
本题解析:
本题难度:一般
4、选择题 钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH。从产生氢气的剧烈程度可推断出这三种物质电离出H+的难易程度是(从难到易的顺序)
[? ]
A.③①②
B.②③①
C.①②③
D.②①③
参考答案:A
本题解析:
本题难度:一般
5、填空题 工业上最早在19世纪中叶便已生产的过氧化氢,目前已经成为社会需求量迅速增长的化学品.原因是它在使用时,很少产生污染.在过氧化氢分子中,一个过氧键:-O-O-(短线表示一对共用电子对),每个氧原子各连着1个氢原子.纯的过氧化氢是蓝色粘稠液体,沸点152.1℃,冰点-0.89℃.
(1)写出过氧化氢的化学式______.
(2)过氧化氢是______化合物(填离子或共价).
(3)写出过氧化氢分子的电子式:______
(4)过氧化氢分子中氧元素的化合价是______.
参考答案:(1)根据题中信息,过氧化氢分子中含有2个氧原子和2个氢原子,分子式为:H2O2,故答案为:H2O2;
(2)过氧化氢分子中不含有离子积,含有的是共价键,所以共价化合物,故答案为:共价;
(3)过氧化氢的电子式为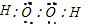 ,故答案为:
,故答案为: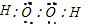 ;
;
(4)过氧化氢分子中,氢元素的化合价是+1价,2个氢原子的化合价为+2价,所以氧原子的化合价为-1价,故答案为:-1.
本题解析:
本题难度:简单