1、选择题 下列离子方程式不正确的是( )
A.向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2H2O
B.在亚硫酸中加入过量的次氯酸钠溶液H2SO3+3ClO-=Cl-+2HClO+SO42-
C.用稀HNO3溶液与FeS固体反应FeS+2H+=Fe2++H2S↑
D.在过氧化钠中加入稀硫酸2Na2O2+4H+=4Na++2H2O+O2↑
参考答案:A、向氢氧化钾溶液中滴加少量氯化铝溶液中生成偏铝酸钾,离子反应为Al3++4OH-=AlO2-+2H2O,故A正确;
B、在亚硫酸中加入过量的次氯酸钠溶液发生氧化还原反应生成硫酸、盐酸和次氯酸,
离子反应为H2SO3+3ClO-=Cl-+2HClO+SO42-,故B正确;
C、稀HNO3溶液与FeS固体(少量)反应生成硝酸铁、NO、水和硫,反应实质错误,故C错误;
D、过氧化钠和稀硫酸反应生成硫酸钠、氧气、水,离子反应为2Na2O2+4H+=4Na++2H2O+O2↑,故D正确;
故选C.
本题解析:
本题难度:简单
2、简答题 A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
请回答下列问题:
(1)A溶液与B溶液反应的离子方程式______.
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为______
(3)请写出B溶液分别与Cl2、Al(OH)3反应的离子方程式:______,______
(4)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是:______.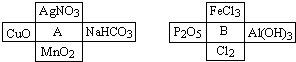
参考答案:结合物质的性质可知A为HCl,B为强碱,如NaOH、KOH等,
(1)A为HCl,B为强碱,二者发生中和反应,离子方程式为H++OH-=H2O,故答案为:H++OH-=H2O;
(2)对比左右两个图中的物质,应为MnO2和浓盐酸反应生成的反应,
反应的离子方程式为MnO2+2Cl-+4H+?△?.?Mn2++Cl2+2H2O,
故答案为:MnO2+2Cl-+4H+?△?.?Mn2++Cl2+2H2O;
(3)Cl2可在碱性条件下自身发生氧化还原反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,Al(OH)3具有两性,能与强碱溶液反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;?Al(OH)3+OH-=AlO2-+2H2O;
(4)既能与酸反应,又能与碱反应的物质可为两性氢氧化物,如Al(OH)3,也可为弱酸的酸式盐,如NaHCO3,
故答案为:Al(OH)3、NaHCO3.
本题解析:
本题难度:一般
3、填空题 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:______________________________________________。
(2)实验②的化学反应中转移电子的物质的量是________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________
参考答案:(每空2分,共6分)
(1)ClO-+2I-+2H+== I2+Cl-+H2O
(2)0.004 mol?
(3)ClO-> I2> SO42-
本题解析:(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;
(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,
设转移电子的物质的量为x.
H2O+SO32-+I2=SO42-+2I-+2H+转移电子
1mol? 2mol
0.5mol·L-1×0.004L? x
x=0.5mol·L-1×0.004L×2mol/1mol
=0.004mol,
答:转移电子的物质的量是0.004 mol;
(3)实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-,答案为:SO42-、I2、ClO-.
考点?:性质实验方案的设计;氧化性、还原性强弱的比较
本题难度:一般
4、选择题 下列文字表述与反应方程式对应正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+ Ag+ = AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C.实验室用液溴和苯在催化剂作用下制溴苯: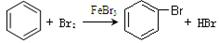
D.硝酸银溶液中滴加过量氨水:Ag+ + NH3·H2O =" AgOH↓+" NH4+
参考答案:C
本题解析:溴乙烷是非电解质,和硝酸银溶液不反应,A不正确;醋酸是弱酸,应该用化学式表示,B不正确;C正确;D不正确,氨水是过量的,生成的应该是氢氧化二银合氨,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题紧扣教材,难易适中,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生规范的答题能力。
本题难度:一般
5、简答题 下列离子方程式正确的是( )
A.向NaHCO3溶液中加入足量的澄清石灰水:HCO3-+OH-+Ca2+=CaCO3↓+H2O
B.FeCl3溶液与铜反应:Fe3++Cu=Fe2++Cu2+
C.向AgCl悬浊液中加入饱和Nal溶液反应的离子方程式:Ag++I-=AgI↓
D.向Ba(OH)2溶液中加入稀硫酸:Ba2++SO42-=BaSO4↓
参考答案:A、向NaHCO3溶液中加入足量的澄清石灰水,碳酸氢钠全部反应,离子方程式为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,故A正确;
B、FeCl3溶液与铜反应的离子方程式应为:2Fe3++Cu=2Fe2++Cu2+,故B错误;
C、向AgCl悬浊液中加入饱和Nal溶液,碘化银溶解度小于氯化银,实现沉淀转化,反应的离子方程式:AgCl+I-?AgI+Cl-,故C错误;
D、向Ba(OH)2溶液中加入稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选A.
本题解析:
本题难度:一般