1、选择题 放在敞口容器中的下列溶液,久置后溶液中溶质的浓度会变大的是()
A.浓硫酸
B.氢氧化钠
C.浓盐酸
D.氯化钠
参考答案:D
本题解析:浓H2SO4因吸水而变稀;NaOH在空气中因变质成Na2CO3导致NaOH的浓度下降;HCl易挥发而浓度下降;NaCl溶液因水分挥发而导致浓度变大。
本题难度:简单
2、实验题 已知Cl2和碱溶液在不同条件下,得到的产物不同。某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。(3Cl2+6KOH KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )

图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过?(填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式为?。需要向烧瓶中加碎瓷片吗??(选填:“需要”、“不需要”)。
(2)反应结束后,烧瓶里的溶液?。
A一定显酸性;B可能显酸性,也可能为中性;C只有氧化性;D只有还原性;E既有氧化性又有还原性
(3)反应完毕,B试管中有少量晶体析出,经冷却后,有大量晶体析出。图中符合该晶体溶解度曲线的是?(填编号字母);从B的试管中分离出该晶体必须用到的玻璃仪器有?。
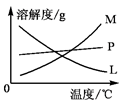
(4)该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有HCl气体。对此问题可以通过改进实验装置的方法进行避免。方法是?。
(5)实验中可观察到D的试管里溶液的颜色由紫色先变为_________色,最终变为________色。
(6)C装置中反应完毕的现象是______________________________________________。
(7)请在装置图方框中画出缺少的实验装置,并注明试剂。
参考答案:分液漏斗(1分);MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)(化学式错误、未配平无分。掉、错反应条件;掉、错关键箭头;等号用成箭头或可逆符号;合计扣1分。此标准下同)。不需要(1分)(所有选填,必须遵守试题说法,否则不给分,例如本空填“不”不给分。此标准下同)
Mn2++Cl2↑+2H2O(2分)(化学式错误、未配平无分。掉、错反应条件;掉、错关键箭头;等号用成箭头或可逆符号;合计扣1分。此标准下同)。不需要(1分)(所有选填,必须遵守试题说法,否则不给分,例如本空填“不”不给分。此标准下同)
(2)AE(2分)(全对得2分,对而不全得1分,其余不得分)
(3)M(1分);漏斗(或普通漏斗、三角漏斗)、玻璃棒(不能写为玻棒)、烧杯(或小烧杯)(1分)?(全对才能得1分)
(4)在A、B装置之间加一个盛饱和食盐水的试管(或洗气瓶、试剂瓶)(2分)(位置1分、试剂1分。独立采分。某点错,不影响另一点得分。位置:A后或B前不得分。试剂:饱和必须有,NaCl可以是其它溶解度较大的盐酸盐。)
(5)红(1分);无(1分) (6)C中试管上部空间充满黄绿色气体(1分,其他合理答案给分)
(7)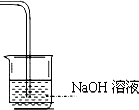 ①试剂为强碱溶液(浓度不作要求)(1分)。②导管要通入液面至少1/3,太浅不可 ③ 是一个敞口体系。(1分)(①和②③分开采分,彼此不牵连。②③错一条,则第2分不给。)
①试剂为强碱溶液(浓度不作要求)(1分)。②导管要通入液面至少1/3,太浅不可 ③ 是一个敞口体系。(1分)(①和②③分开采分,彼此不牵连。②③错一条,则第2分不给。)
本题解析:(1)向烧瓶中加热浓盐酸,需要借助于分液漏斗。在加热的条件下二氧化锰氧化浓盐酸生成氯气,反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;由于在反应中二氧化锰不溶于水,以固体的形式存在,因此反应中不需要再加热碎瓷片。
Mn2++Cl2↑+2H2O;由于在反应中二氧化锰不溶于水,以固体的形式存在,因此反应中不需要再加热碎瓷片。
(2)由于在反应过程中浓盐酸的浓度逐渐降低,而二氧化锰不能氧化稀盐酸,所以反应结束后盐酸一定剩余,溶液显酸性。同时反应中还生成氯化锰具有还原性。而溶液中的氢离子还具有氧化性,所以答案选AE。
(3)冷却后有大量晶体析出,这说明该物质的溶解度受温度的影响较大。且溶解度随温度的升高而增大,所以符合条件的曲线是M。从溶液中分离出固体的操作是过滤,需要的玻璃仪器有漏斗、玻璃棒、烧杯。
(4)由于氯化氢极易溶于水,氯气在水中的溶解度较小,所以要除去氯气中的氯化氢气体,可以通入到盛有饱和食盐水的洗气瓶中,即正确做法是在A、B装置之间加一个盛饱和食盐水的洗气瓶。
(5)氯气溶于水生成盐酸与次氯酸。溶液显酸性,则石蕊试液变为红色。又因为次氯酸还具有强氧化性,能漂白酸碱指示剂,因此溶液最终变为无色。
(6)在冰水浴中氯气与氢氧化钠溶液的反应很慢,且氯气在水中的溶解度很小,所以C装置中反应完毕的现象是C中试管上部空间充满黄绿色气体。
(7)氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,则实验装置图为 。
。
本题难度:一般
3、选择题 卤素原子之间可以形成类似卤素单质的分子,如溴化碘(IBr)能跟大多数金属反应生成金属卤化物,能跟水反应,其化学方程式为IBr+H2O====HBr+HIO。下面有关IBr的叙述中不正确的是 (? )
A.在很多反应中IBr是强氧化剂
B.IBr与H2O反应时,其氧化产物是HBr,还原产物是HIO
C.IBr跟NaOH溶液反应生成NaBr、NaIO和H2O
D.IBr跟金属锌反应生成ZnBr2和ZnI2
参考答案:B
本题解析:IBr为化合物,I元素为+1价,Br元素为-1价,IBr与H2O或NaOH反应时,均发生非氧化还原反应,I、Br的价态均不变。与金属反应时,+1价I表现出强氧化性。
本题难度:简单
4、选择题 下列说法不正确的是?
[? ]
A.?采用原煤脱硫技术,可减少燃煤燃烧时产生的SO2 ?
B.?自来水可用氯气来杀菌消毒,说明氯气无毒 ?
C.?氮氧化物可以破坏臭氧层,也能形成酸雨
D.?化石燃料燃烧产生大量CO2,会导致温室效应
参考答案:B
本题解析:
本题难度:简单
5、选择题 下图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是

[? ]
A.浓H2SO4
B.饱和NaBr溶液
C.浓NaOH溶液
D.H2O
参考答案:D
本题解析:
本题难度:简单