1、填空题 在10℃和4×105Pa的条件下,当反应aA(g)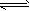 dD(g)+eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后,物质D的浓度见下表(在增大压强的过程中无其他副反应发生)
dD(g)+eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后,物质D的浓度见下表(在增大压强的过程中无其他副反应发生)

(1)压强从4×105Pa增加到6×105Pa时平衡应向__________反应方向移动(填“正”或“逆”),理由是
__________________。
(2)压强从1×106Pa增加到2×106Pa时,平衡向__________反应方向移动。此时平衡向该方向移动的两个必要条件是①__________,②__________。
参考答案:(1)逆;加压时生成物D浓度增大的倍数小于压强增大的倍数
(2)正;①a>d;②生成物E在该条件下的状态为非气态
本题解析:
本题难度:一般
2、选择题 下列事实不能用勒夏特列原理解释的是( )
A.用排饱和食盐水法收集Cl2
B.温度控制在450℃有利于二氧化硫的催化氧化
C.增大压强有利于合成氨反应
D.工业制取金属钾?Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
参考答案:A.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,故A不选;
B.2SO2(g)+O2(g)?2SO3(g)正反应是放热反应,升高温度平衡向逆反应方向移动,不利用三氧化硫的生成,温度控制在450℃,考虑该温度下反应速率较快、催化剂的活性最高,不能用勒夏特列原理解释,故B选;
C.对N2(g)+3H2(g)?2NH3(g),正反应为气体总物质的量减小的反应,增大压强平衡向正反应方向移动,有利于氨气的合成,可以用勒夏特列原理解释,故C不选;
D.使K成蒸气从反应混合物中分离出来,降低K蒸气的浓度,平衡向正反应方向移动,有利于K的制备,可以用勒夏特列原理解释,故D不选;
故选B.
本题解析:
本题难度:一般
3、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
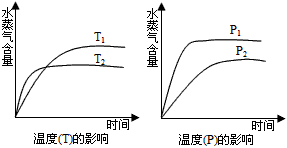
[? ]
A.CO2(g)+2NH3(g) === CO(NH2)2(s)+H2O;ΔH<0
B.CO2(g)+H2(g) === CO(g)+H2O(g) ;ΔH>0
C.CH3CH2OH(g) === CH2=CH2(g)+H2O(g) ;ΔH>0
D.2C6H5CH2CH3(g)+O2(g) === 2C6H5CH=CH2(g)+2H2O(g) ;ΔH<0
参考答案:A
本题解析:
本题难度:一般
4、填空题 在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内分压与反应温度的关系如下图所示(已知气体的分压之比等于物质的量之比)。
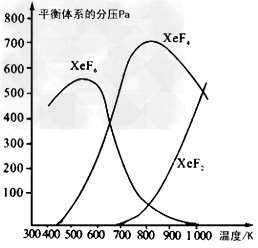
(1)420K时,发生反应的化学方程式为_______________________。若反应中消耗1?mol Xe,则转移电子_______mol。
(2)600K~800K时,会发生反应:XeF6(g) XeF4(g)+?F2(g),其反应热△H ____(填“>”“=”或“<”)0。理由是______________________。
XeF4(g)+?F2(g),其反应热△H ____(填“>”“=”或“<”)0。理由是______________________。
(3)900K时,容器中存在的组分有__________。
参考答案:(1)Xe?+3F2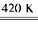 XeF6;6?
XeF6;6?
(2)>;由图可知升高温度XeF6减少,XeF4增多,说明平衡向右移动,所以正反应是吸热反应?
(3)?XeF4、XeF6、XeF2、Xe、F2
本题解析:
本题难度:一般
5、选择题 对于mA(g)+nB(g)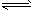 pC(g)+gD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从
pC(g)+gD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从
16.9变为16.5。则下列判断正确的是
[? ]
A. m+n>p+g 正反应是放热反应
B. m+n>p+g 正反应是吸热反应
C. m+n<p+g 逆反应是放热反应
D. m+n<p+g 逆反应是吸热反应
参考答案:AC
本题解析:
本题难度:一般