1、简答题 实验室用Na2SO4?10H2O配制0.1mol/L的Na2SO4溶液500ml.有以下仪器:
①药匙?②100ml量筒?③1000ml容量瓶?④锥形瓶?⑤玻璃棒?⑥烧杯
(1)配制时,必须选用的仪器为:______(填代号),还缺少的玻璃仪器为______
(2)经计算,本实验需称量硫酸钠晶体(Na2SO4?10H2O)为______g.
(3)用Na2SO4?10H2O配制标准溶液的正确顺序是______.
A.冷却?B.称量?C.洗涤?D.定容?E.溶解?F.摇匀?G.移液
(4)将所配制的Na2SO4溶液进行测定,发现浓度大于0.1mol/L.请你分析配制过程中可能引起该误差的原因是(填字母代号)______
①容量瓶不干燥,含有少量蒸馏水?②定容时俯视刻度线?③定容时仰视刻度线?④未冷却至室温就转移到容量瓶中?⑤没有洗涤烧杯和玻璃棒.
2、填空题 483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的 量是 ,所含H2O分子的数目是 个。
3、选择题 下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
A.1L溶液中含有K+、SO42-总数为0.03NA
B.1L溶液中含有K+数目是0.1NA
C.1 L溶液中K+的浓度是0.20 mol / L
D.2 L溶液中含有SO42-的浓度是0.3mol / L
4、选择题 设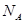 表示阿伏加德罗常数,下列叙述中正确的是?
表示阿伏加德罗常数,下列叙述中正确的是?
①.31g白磷含有的P—P键数为NA?
②. 1mol CH3+(碳正离子)中含有电子数为10NA?
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA?
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子?
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA?
⑥.0.84 g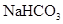 晶体中阳离子和阴离子总数为0.03NA?
晶体中阳离子和阴离子总数为0.03NA?
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA?
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA?
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023?
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧? B ③④⑥⑦⑧? C ④⑦? D④⑥⑨⑩
5、实验题 (15分)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,回答下列问题:
(1)请简要叙述该实验的主要实验步骤:
①__________________;②__________________;
③__________________;④__________________;
⑤__________________;⑥__________________。
(2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:_________________________________________
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有_______________;偏小的有 ;无影响的有 。
A.称量时使用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶中移液时,有少量液体溅出