1、选择题 下列金属冶炼的反应原理中正确的是
A.2AlCl3(熔融)  2Al+3Cl2↑
2Al+3Cl2↑
B.MgO+H2 Mg+H2O
Mg+H2O
C.ZnO+CO  Zn+CO2
Zn+CO2
D.2CuO  2Cu+O2↑
2Cu+O2↑
2、选择题 化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。下列不属于化学研究发展方向或说法不正确的是?(?)
A.高铁酸钾广泛用于废水的净化处理,因为它具有强还原性
B.最近合成117号元素的反应为: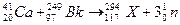 ,该变化不属于化学变化
,该变化不属于化学变化
C.“原子经济”和“零排放”是绿色化学和化工的发展目标
D.最近在星际介质中发现的分子薏(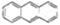 ),该分子中所有原子可以处于同一平面
),该分子中所有原子可以处于同一平面
3、填空题 (12分)碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1,4
|
沉淀完全pH
| 13
| 14
| 3.7
|
(1)氯酸钠的作用是?;
(2)调节溶液A的pH范围为?,可以选择的试剂是?.(填序号)。
a.氨水? b.硫酸铜? c.氢氧化铜? d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是?;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是?。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:?。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净?。
4、填空题 (10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。

(1)写出溶液B的溶质是?。
(2)参照以下框的形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。

(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成 Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是?。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移到25.00mL试样溶液,用0.0050mol·L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是?。
5、选择题 下列金属冶炼的反应原理,不正确的是(? )
A.2NaCl(熔融)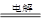 2Na+Cl2↑
2Na+Cl2↑
B.MgO+H2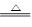 Mg+H2O
Mg+H2O
C.Fe2O3+3CO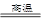 2Fe+3CO2
2Fe+3CO2
D.2Ag2O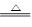 4Ag+O2↑
4Ag+O2↑