1、填空题 已知五种短周期元素的原子序数大小顺序为C>A>B>D>E, A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出E和B形成的化合物分子含非极性共价键的结构式:____________________;?
写出A、B、E形成的化合物的电子式:______________。
(2)比较A、B、C三种离子的半径大小_________________(用离子符号表示)。
(3)写出均由A、B、C、E四种元素组成的二种化合物相互反应的离子方程式?
参考答案:(1) H-O-O-H? NaOH电子式: ?(2)S2-﹥O2-﹥Na+?(3)H++HSO3-=H2O+SO2 ↑
?(2)S2-﹥O2-﹥Na+?(3)H++HSO3-=H2O+SO2 ↑
本题解析:(1)短周期元素的原子序数大小顺序为C>A>B>D>E,D和E可形成4核10电子的分子。则D是N,E是H.。 A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;A是Na,B是O. B、C同主族。短周期元素中原子序数C>A>B,C是S。即A:Na,B:O.C:S,D:N,E:H.。所以E和B形成的化合物过氧化氢分子含非极性共价键的结构式:H-O-O-H。A、B、E形成的化合物NaOH的电子式:
(2)S2-有3个电子层,Na+、O2-都有2个电子层,对于电子层不同的离子,离子的电子层越多,离子半径越大;对于电子层相同的离子,核电荷数越大,离子半径越小。所以这三种离子半径大小为: S2-﹥O2-﹥Na+(3)有Na、O、S、H.四种元素组成的化合物是NaHSO4 和NaHSO3.它们发生反应的化学方程式是NaHSO4 +NaHSO3=Na2SO4+H2O+SO2↑.离子方程式为:H++HSO3-=H2O+SO2 ↑。
本题难度:一般
2、填空题 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)

(1)A的氢化物A2H2分子的空间构型为__________,其中心原子采取的杂化形式为___________,分子中含有___________个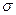 键,__________π键。
键,__________π键。
(2)写出化合物DC的电子式_______,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
参考答案: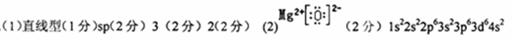

本题解析:略
本题难度:简单
3、选择题 下列叙述中,错误的是(? )
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.酸性:HClO4>H2SO4>H3PO4
D.稳定性:HF>HCl>HBr
参考答案:A
本题解析:Na、Mg、Al为同周期元素,原子序数依次增大,金属性依次减弱,还原性依次减弱,B项正确;Cl、S、P为第三周期元素,原子序数Cl>S>P,非金属性Cl>S>P,酸性:HClO4>H2SO4>H3PO4,C项正确;F、Cl、Br为ⅦA族元素,非金属性F>Cl>Br,稳定性HF>HCl>HBr,D项正确;A项错误。
本题难度:一般
4、选择题 下列物质属于纯净物的是
A.苯
B.天然气
C.汽油
D.煤
参考答案:A
本题解析:由同一种物质形成的是纯净物,同不同种物质形成的是混合物,苯是纯净物,其余都是混合物,答案选A。
本题难度:简单
5、选择题 人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是
A.离子化合物
B.电解质
C.钠盐
D.碱性氧化物
参考答案:D
本题解析:碳酸钠中含有离子键,属于离子化合物,在水中能电离出阴阳离子,水电解质。阳离子是钠离子,属于钠盐。碱性氧化物是指和酸反应生成盐和水的氧化物,属于碳酸钠不属于碱性氧化物。答案是D。
本题难度:困难