1、选择题 将50mL0.2mol /L的NaCl溶液加水稀释成0.1mol/L的NaCl溶液时,稀释后溶液的体积为( )
A.100mL
B.200mL
C.150mL
D.50mL
参考答案:令稀释后溶液的体积为V,根据稀释定律,稀释前后溶质氯化钠的物质的量不变,则:
50mL×0.2mol/L=V×0.1mol/L,
解得V=100mL,
故选A.
本题解析:
本题难度:一般
2、选择题 相对分子质量为M的某物质在室温下的溶解度为S,此时测得饱和溶液的密度为d?g?cm-3,则该饱和溶液的物质的量浓度为
A.mol?L-1
B.mol?L-1
C.mol?L-1
D.mol?L-1
参考答案:C
本题解析:分析:饱和溶液,由溶解度可计算质量分数,密度为d?g?cm-3,再利用c=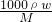 来计算.
来计算.
解答:在室温下的溶解度为S,此时测得饱和溶液的密度为d?g?cm-3,
溶质的质量分数为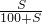 ×100%,
×100%,
由相对分子质量为M,c=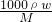 ,
,
则c=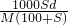 mol/L,
mol/L,
故选C.
点评:本题考查物质的量浓度的计算,熟悉质量分数与饱和溶液的溶解度的关系,质量分数与物质的量浓度的关系即可解答,难度不大.
本题难度:简单
3、填空题 (8分)H2SO4的摩尔质量是 ,196g H2SO4的物质的量是 ,其中含有 g O和 molH。
参考答案:98g/L 2mol 128 4
本题解析:如果质量的单位用g表示,则摩尔质量在数值上等于物质的相对分子质量或相对原子质量,所以硫酸的摩尔质量是98g/mol。根据n=m/M可知,196g硫酸的物质的量是196g÷98g/mol=2mol。根据硫酸的化学式可知,含有2mol×2=4mol氢原子和2mol×4mol=8mol氧原子,则氧原子的质量是16g/mol×8mol=128g。
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式 、n=m/M、
、n=m/M、 、
、 等。
等。
本题难度:一般
4、选择题 下列叙述的两个量,一定相等的是( )
A.质量相等的金刚石和C60中的碳原子数目
B.0.1 mol/L NaCl溶液与0.05 mol/L Na2CO3溶液中所含Na+的数目
C.标准状况下等体积的SO2和SO3的分子数目
D.等体积pH都为3的稀盐酸与FeCl3溶液中,由水电离产生的H+数目
参考答案:A
本题解析:金刚石和C60均只由碳原子组成,质量相等,则碳原子数目相等,A项正确;B项中未给出溶液的体积,溶液中Na+数目多少无法比较,错误;标准状况下SO2为气体而SO3为固体,C项错误;稀盐酸中水的电离受到抑制而FeCl3溶液中水的电离受到促进,故后者水电离出的H+浓度大于前者,D项错误
本题难度:一般
5、选择题 在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含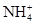 的物质的量为b mol。下列叙述中正确的是(?)
的物质的量为b mol。下列叙述中正确的是(?)
A.溶质的质量分数为w=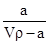 ×100%
×100%
B.溶质的物质的量浓度c=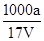 mol/L
mol/L
C.溶液中c(OH-)=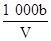 mol/L
mol/L
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
参考答案:B
本题解析:根据题中给的已知量及各小题的要求,利用待求量的最基本计算关系代入求解即可。A不正确,w应为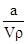 ×100%;根据公式c=
×100%;根据公式c=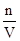 进行计算知B正确;由溶液中的电荷守恒可知C不正确;因为氨水的密度小于水的密度,故上述溶液再加V mL水后,所得溶液溶质的质量分数小于0.5w,D不正确。
进行计算知B正确;由溶液中的电荷守恒可知C不正确;因为氨水的密度小于水的密度,故上述溶液再加V mL水后,所得溶液溶质的质量分数小于0.5w,D不正确。
本题难度:一般