| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》高频考点预测(2019年最新版)(四)
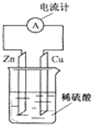 参考答案:A、锌、铜和稀硫酸组成的原电池,电池总反应为Zn+H2SO4=ZnSO4+H2↑,则反应物是锌和稀硫酸,故A正确; 本题解析: 本题难度:一般 5、填空题 (10分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
根据以上实验记录,完成以下填空: (1)构成两电极的金属活动性相差越大,电压表的读数越___________(填“大”、“小”)。 Zn、A、B三种金属活动性由强到弱的顺序是__________________________。 (2)Cu与A组成的原电池,_____为负极,此电极反应式为___________________。 (3)A、B形成合金,露置在潮湿空气中,_______先被腐蚀。 参考答案:(10分)(1)大?(2分) 本题解析:略 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《硫化氢》在.. | |