1、选择题 下列有关碱金属铷(Rb)的叙述中,正确的是
[? ]
A.硝酸铷是离子化合物,易溶于水
B.氢氧化铷是弱碱
C.在钠、钾、铷三种单质中,铷的熔点最高
D.铷在氧气中燃烧,产物为Rb2O
参考答案:A
本题解析:
本题难度:一般
2、选择题 在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况,下列反应中属于这种情况的是
①过量的Zn与18 mo1/L硫酸溶液反应;
②过量的氢气与少量的氮气在催化剂存在一定条件下充分反应;
③过量的水与一定量氯气;
④过量的铜与浓硫酸;
⑤过量的铜与稀硝酸;
⑥过量的稀硫酸与块状石灰石;
⑦常温下过量浓硫酸与铝
A.②③⑤
B.②③④⑥⑦
C.①④⑤
D.①②③④⑤
参考答案:B
本题解析:①开始时是浓硫酸,发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。随着反应的进行,硫酸变稀,发生反应:Zn+H2SO4(稀)=ZnSO4+H2↑。硫酸溶液会完全反应; 错误。②N2+3H2 2NH3.由于该反应为可逆反应,所以无论二者以何种比例混合,反应都不可能完全进行。正确。③Cl2+H2O
2NH3.由于该反应为可逆反应,所以无论二者以何种比例混合,反应都不可能完全进行。正确。③Cl2+H2O HCl+HClO由于该反应为可逆反应,所以反应都不可能完全进行。正确。④Cu+2H2SO4(浓)
HCl+HClO由于该反应为可逆反应,所以反应都不可能完全进行。正确。④Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O随着反应的进行,硫酸变为稀硫酸,这时反应就不再进行。正确。⑤过量的铜与稀硝酸3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O直至硝酸反应完全。错误。⑥H2SO4+CaCO3= CaSO4+H2O+CO2↑。由于发生反应产生的CaSO4微溶解于水,覆盖在CaCO3的表面,使反应不能继续发生。正确。⑦常温下过量浓硫酸与铝接触。由于浓硫酸有强氧化性,在Al的表面产生一薄层致密的氧化物薄膜,对内层的金属起到了保护作用,而阻止了反应的继续进行。正确。因此符合题意的选项②③④⑥⑦。答案为B。
CuSO4+SO2↑+2H2O随着反应的进行,硫酸变为稀硫酸,这时反应就不再进行。正确。⑤过量的铜与稀硝酸3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O直至硝酸反应完全。错误。⑥H2SO4+CaCO3= CaSO4+H2O+CO2↑。由于发生反应产生的CaSO4微溶解于水,覆盖在CaCO3的表面,使反应不能继续发生。正确。⑦常温下过量浓硫酸与铝接触。由于浓硫酸有强氧化性,在Al的表面产生一薄层致密的氧化物薄膜,对内层的金属起到了保护作用,而阻止了反应的继续进行。正确。因此符合题意的选项②③④⑥⑦。答案为B。
本题难度:一般
3、选择题 下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硫酸具有吸水性,因此浓硫酸可以干燥某些气体
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价
参考答案:C
本题解析:A项:SO2具有漂白性不是因为他有还原性,而是他和有色物质反应生成新的无色有机物,所以经过SO2漂白的物品过一段时间会从新有颜色,最明显的就是编织物用久了发黄,故错。B项:不可以,水溶液就不需要说了,Na和水反应,即使熔融也不行,MgCl2熔融的时候,Na都成蒸汽了,所以不能反应制取Mg一般电解熔融MgCl2即可,故错。D项:Fe与S反应生成FeS,是+2价,故错。故选C。
点评:本题考查的是有关无机物的性质的相关知识,内容多源自于课本,学生要注重对课本知识的学习和积累。
本题难度:一般
4、选择题 A、B、C为短周期元素,A的最外层电子数是次外层的3倍,B是最活泼的非金属元素,C的氯化物是氯碱工业的原料,下列叙述正确的是
[? ]
A.A是O,B是Cl
B.A、B、C的原子半径大小关系是:A>C>B
C.B的气态氢化物比A的稳定
D.向AlCl3溶液中加过量C的最高价氧化物对应水化物可得白色沉淀
参考答案:C
本题解析:
本题难度:一般
5、选择题 亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2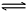 LiNH2+LiH。下列有关说法正确的是
LiNH2+LiH。下列有关说法正确的是
[? ]
A.Li2NH中N的化合价是-1
B.此法储氢和钢瓶储氢的原理相同
C.Li+和H-的离子半径相等
D.该反应中H2既是氧化剂又是还原剂
参考答案:D
本题解析:
本题难度:简单