1、选择题 下列说法正确的是
A.Fe的摩尔质量是56g
B.NH3的摩尔质量是17?g/mol
C.氧的摩尔质量是16?g/mol
D.1?mol?Na的质量是23?g/mol
参考答案:B
本题解析:分析:A、摩尔质量的单位是g/mol;
B、摩尔质量的单位是g/mol,数值上等于相对分子质量;
C、物质指示不明确;
D、质量的单位是g.
解答:A、Fe的摩尔质量是56g/mol,故A错误;
B、NH3的相对分子质量为17,所以NH3的摩尔质量是17?g/mol,故B正确;
C、氧原子的摩尔质量是16?g/mol,故C错误;
D、1?mol?Na的质量是23?g,故D错误;
故选B.
点评:本题主要考查了摩尔质量的有关概念,难度不大.
本题难度:简单
2、选择题 阿佛加德罗常数用NA表示,下列叙述正确的是
A.室温时,0.1L?1mol?L-1的盐酸,溶液中水电离出的H+数为10-13NA
B.1L?0.2mol?L-1MgSO4溶液中的阳离子数小于0.2NA
C.2.88g?ND2中含有的电子数是0.18NA
D.常温常压下,3g?HCHO和CH3COOH混合物中含有0.4NA个原子
参考答案:D
本题解析:分析:A、依据稀酸溶液中离子积常数计算得到;
B、溶液中阳离子为镁离子和氢离子,镁离子水解生成的氢离子,阳离子增多;
C、n= 计算物质的量结合取代基计算电子数;
计算物质的量结合取代基计算电子数;
D、HCHO和CH3COOH最简式相同为CH2O,只需计算3gCH2O中含原子数;
解答:A、室温时,0.1L 1mol?L-1的盐酸,c(H+)=1mol/L;溶液中c(H+)c(OH-)=10-14溶液中水电离出的H+数为10-14NA,故A错误;
B、1L 0.2mol?L-1MgSO4溶液中,Mg2++2H2O?Mg(0H)2↓+2H+;1L 0.2mol?L-1MgSO4溶液中的阳离子数大于0.2NA,故B错误;
C、2.88g ND2中物质的量=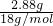 =0.16mol;含有的电子数是0.16mol×9×NA=1.44NA,故C错误;
=0.16mol;含有的电子数是0.16mol×9×NA=1.44NA,故C错误;
D、HCHO和CH3COOH最简式相同为CH2O,只需计算3gCH2O中含原子数=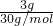 ×4×NA=0.4NA个,故D正确;
×4×NA=0.4NA个,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要是溶液中离子积的计算应用,盐类水解的分析判断,质量换算物质的量计算微粒数,题目难度中等.
本题难度:困难
3、选择题 用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.7.8g过氧化钠中含有的离子数为0.4NA
B.5.6g铁与14.2g氯气充分反应转移的电子数为0.2NA
C.在标准状况下,22.4?L?CH4与18g?H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4L的CO气体与1?mol?N2所含的电子数相等
参考答案:C
本题解析:分析:A、蒸馏换算物质的量结合过氧化钠构成计算;
B、蒸馏换算物质的量,结合化学方程式判断过量计算,依据完全反应的物质计算电子转移数;
C、气体摩尔体积换算物质的量,蒸馏换算物质的量,结合分子式计算电子数;
D、22.4L的CO气体不一定是1mol.
解答:A、7.8g过氧化钠物质的量为0.1mol,过氧化钠含两个钠离子和一个过氧根离子,含离子数为0.3NA,故A错误;
B、5.6g铁物质的量为0.1mol,14.2g氯气物质的量为0.2mol,充分反应2Fe+3Cl2=2FeCl3;铁全部反应转移电子数为0.3mol,故B错误;
C、在标准状况下,22.4?L?CH4与18g?H2O的物质的量都是1mol,分子都是10电子微粒,所含有的电子数均为10NA,故C正确;
D、22.4L的CO气体物质的量不一定是1mol,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查蒸馏换算物质的量计算微粒数,气体摩尔体积的条件应用.
本题难度:简单
4、选择题 把100克10%KNO3溶液的浓度增加到20%,可以采用的方法是
A.蒸发掉45克水
B.蒸发掉50克水
C.加入10克KNO3固体
D.加入15克KNO3固体
参考答案:B
本题解析:分析:把10%的溶液的溶质质量分数增加一倍到20%,可采取增加溶质或蒸发溶剂的方法;增加溶质时,溶剂质量不变,溶液质量随溶质溶解而增加;蒸发溶剂时,溶质质量不变而溶剂减少溶液质量也随之减小;根据溶质质量分数=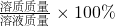 计算变化中增加溶质的质量或蒸发溶剂的质量.
计算变化中增加溶质的质量或蒸发溶剂的质量.
解答:设需要增加溶质的质量为x
 =20%
=20%
解之得 x=12.5g
设需要蒸发溶剂的质量为y
 =20%
=20%
解之得 y=50g
故选B.
点评:要使溶液的溶质质量分数增加一倍,不能简单地认为把溶质质量增加一倍或把溶剂质量减小一半即可;通过计算可发现增加溶质的质量大于原溶质质量的一倍,蒸发溶剂的质量应为原溶液的一半.
本题难度:困难
5、选择题 100℃时,KCl溶液中溶质的物质的量浓度为C1.降至室温后析出m?g?KCl晶体(晶体中不含结晶水),所得溶液中溶质的物质的量浓度为C2,则下列说法不正确的是
A.一定条件下,KCl的溶解度是有限的
B.溶液中KCl的物质的量浓度C1一定大于C2
C.降温前后,溶液中KCl的物质的量未发生改变
D.降温过程中,结晶和溶解的速率可能出现相等
参考答案:C
本题解析:分析:溶液中固体的溶解和结晶为可逆过程,降至室温后析出mgKCl晶体,说明随着温度的降低,溶解度降低,由于溶液体积不变,则溶液的质量分数,物质的量浓度都减小,以此解答该题.
解答:A.不同温度下,KCl的溶解度不同,且溶剂不同,溶解度也不同,故A正确;
B.降至室温后析出mgKCl晶体,由于溶液体积不变,物质的量浓度减小,故B正确;
C.降至室温后析出mgKCl晶体,溶液中KCl的物质的量分数改变,故C错误;
D.溶液中固体的溶解和结晶为可逆过程,当达到平衡时,结晶和溶解的速率相等,故D正确.
故选C.
点评:本题考查溶液的物质的量浓度大比较、溶解度等问题,题目难度不大,注意把握饱和溶液的特点以及影响溶解平衡的因素.
本题难度:简单