1、选择题 下列各物质中所含氢原子个数与3.2gO2分子数相同的物质是
A.0.2gNH3
B.6.02×1023个H2SO4分子
C.0.1molHCl分子
D.标准状况下1.12LCH4
参考答案:C
本题解析:分析:利用n= 来计算氧气的物质的量,再利用n=
来计算氧气的物质的量,再利用n= 、n=
、n= 、n=
、n= 及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
及物质的构成来计算氢原子的物质的量,若氢原子的物质的量与氧气的物质的量相等,则个数相同.
解答:3.2gO2的物质的量为 =0.1mol,
=0.1mol,
A、氨气的物质的量为 =0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
=0.012mol,氢原子的物质的量为0.012mol×3=0.036mol,故A错误;
B、H2SO4分子的物质的量为 =1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
=1mol,氢原子的物质的量为1mol×2=2mol,故B错误;
C、0.1molHCl分子中氢原子的物质的量为0.1mol×1=0.1mol,故C正确;
D、标准状况下甲烷的物质的量为 =0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
=0.5mol,氢原子的物质的量为0.5mol×4=2mol,故D错误;
故选C.
点评:本题考查学生利用n= 、n=
、n= 、n=
、n= 及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
及物质的构成进行的简单计算,明确氢原子的个数与氧分子数相同,即选项中氢原子的物质的量与氧气的物质的量相等是解答本题的关键.
本题难度:困难
2、选择题 NA为阿伏伽德罗常数,下列叙述错误的是
A.标准状况下,足量Fe与22.4L Cl2反应,转移电子数为3NA
B.18g水中含有的电子数为10NA
C.28g CO和N2混合气体中含有原子总数为2NA
D.1mol?Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为NA
参考答案:A
本题解析:分析:A、铁和氯气反应生成氯化铁,氯气全部反应,依据氯气计算电子转移数;
B、质量换算物质的量结合分子式计算电子数;
C、CO和N2摩尔质量相同为28g/mol,依据n= 计算物质的量,一氧化碳和氮气是双原子分子计算原子数;
计算物质的量,一氧化碳和氮气是双原子分子计算原子数;
D、依据1mol钠完全反应失去电子1mol分析;
解答:A、铁和氯气反应生成氯化铁,氯气全部反应,标准状况下,足量Fe与22.4L Cl2反应,转移电子数为2NA,故A错误;
B、18g水物质的量为1mol,含有的电子数为10NA,故B正确;
C、CO和N2摩尔质量相同为28g/mol,28g CO和N2混合气体物质的量为1mol,一氧化碳和氮气是双原子分子,含有原子总数为2NA,故C正确;
D、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠全部反应,钠失去电子数为NA,故D正确;
故选A.
点评:本题考查阿伏伽德罗常数的应用,主要考查氧化还原反应的电子转移计算,质量换算物质的量计算微粒数,题目难度中等.
本题难度:一般
3、选择题 用1L?1mol?L-1NaOH溶液吸收0.9molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比是
A.5:4
B.4:5
C.1:8
D.8:1
参考答案:C
本题解析:分析:用1L?1mol?L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,根据Na元素和C元素守恒列式计算.
解答:用1L?1mol?L-1NaOH溶液吸收0.9molCO2,所得产物有Na2CO3和NaHCO3,
设生成xmolNa2CO3,ymolNaHCO3,
则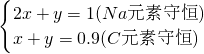
解之得:
所得溶液中的CO32-和HCO3-的物质的量浓度之比等于物质的量之比,为0.1:08=1:8,
故选C.
点评:本题考查物质的量浓度的计算,题目难度不大,注意从质量守恒的角度分析.
本题难度:简单
4、选择题 若某氖原子质量是a?g,12C的原子质量是b?g,NA是阿伏加德罗常数的值,下列说法正确的是
A.氖元素的相对原子质量一定是12a/b
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量一定是mol
D.Wg该氖原子所含质子数是10W/a
参考答案:C
本题解析:分析:A、根据元素的相对原子质量含义计算;
B、依据摩尔质量概念分析计算;
C、根据物质的量的概念计算;
D、质量换算为物质的量进而计算质子数;
解答:A、氖原子的相对原子质量= =
= ,氖元素存在同位素,氖元素的相对原子质量是同位素所占体积分数的平均值,故A错误;
,氖元素存在同位素,氖元素的相对原子质量是同位素所占体积分数的平均值,故A错误;
B、氖原子的摩尔质量是1mol原子的质量即aNAg?mol-1,故B错误;
C、Wg该氖原子的物质的量= =
= mol,故C正确;
mol,故C正确;
D、Wg该氖原子所含质子数=1mol氖原子所含质子数×物质的量=2× ,故D错误;
,故D错误;
故选C
点评:本题考查了原子相对原子质量、元素相对原子质量、摩尔质量、物质的量等概念的理解与应用.
本题难度:困难
5、选择题 下列有关气体摩尔体积的描述中正确的是
A.1mol气体的体积就是该气体的摩尔体积
B.通常状况下的气体摩尔体积约为22.4L
C.标准状况下的气体摩尔体积约为22.4L?mol-1
D.单位物质的量的气体所占的体积就是气体摩尔体积
参考答案:C
本题解析:分析:A、一定温度和压强下,1mol气体的体积就是该气体的摩尔体积;
B、标准状况气体摩尔体积约为22.4L/mol;
C、准状况下的气体摩尔体积约为22.4L?mol-1
D、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积.
解答:A、温度和压强不知,1mol气体的体积不一定是该气体的摩尔体积,故A错误;
B、标准状况气体摩尔体积约为22.4L/L,故B错误;
C、标准状况下的气体摩尔体积约为22.4L?mol-1,故C正确;
D、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积,故D错误;
故选C.
点评:本题考查了气体摩尔体积的应用条件分析判断,温度压强是气体摩尔体积的前提条件,一定温度压强的气体,1mol气体体积一定,题目较简单.
本题难度:困难