1、选择题 下列物质属于电解质的是(?)
A.金属钠
B.硫酸钠
C.干冰
D.石墨
参考答案:B
本题解析:溶液水或在熔融状态下能够导电的化合物是电解质,B正确,钠和石墨都是单质,不是电解质,也不是非电解质。干冰是CO2,属于非电解质,答案选B。
点评:判断电解质的关键不是看能否导电,关键是要看溶于水或在熔融状态下,能否电离出离子,能够自身电离出离子的化合物才是电解质,而导电只是一种现象。
本题难度:一般
2、选择题 下列说法正确的是:①电解质溶液导电过程属于化学变化,②酸性氧化物都是非金属氧化物,③FeC12、Fe(OH)3、Fe3O4都能通过化合反应来制取 ④Na2O2不是碱性氧化物
[? ]
A.②③④
B.①④
C.①③④
D.②③
参考答案:C
本题解析:
本题难度:一般
3、选择题 关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
[? ]
A.溶液的pH:①>③>②
B.水电离出的c(H+):③>②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+ c(NH3·H2O)
D.①和③等体积混合后的溶液呈碱性:c(NH4+)> c(Cl-)>c(OH-)>c(H+)
参考答案:B
本题解析:
本题难度:一般
4、填空题 (4分)通常状况下,下列物质中①硫酸钡;②醋酸;③氯化氢;④三氧化硫;⑤氯气;⑥碳酸氢钠;⑦铜;⑧硫酸溶液;⑨氢氧化钾;⑩乙醇(下列各空填序号)
(1)属于强电解质的是:______________________________
(2)属于弱电解质的是:______________________________
(3)能导电的是:________________________________________
(4)属于非电解质的是:________________________________________
参考答案:23. (4分,每空1分)(1)属于强电解质的是:①③⑥⑨
(2)属于弱电解质的是:②
(3)能导电的是:⑦⑧
(4)属于非电解质的是:⑩④
本题解析:根据电解质的定义和分类,一般强电解质为强酸、强碱、大多数盐、活泼金属氧化物;弱电解质为弱酸、弱碱、水;非电解质为非金属化合物和大多数有机化合物。能导电,必须能电离出离子和金属单质。
本题难度:一般
5、填空题 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
(1)已知在25℃,101kPa时,16.0g?N2H4在氧气中完全燃烧生成氮气,放出热量312kJ,N2H4完全燃烧反应的热化学方程式是______.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是:______.电池工作一段时间后,电解质溶液的pH将______(填“增大”、“减小”、“不变”).
(2)如图是一个电化学装置示意图.用肼--空气燃料电池做此装置的电源.如果A是铂电极,B是石墨电极,C是500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为______,则肼-空气燃料电池理论上消耗的空气______L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______.
(4)常温下将0.2mol/L?HCl溶液与0.2mol/L?N2H4?H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)______0.1mol/L?HCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”).
(5)已知:在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L?N2H4?H2O溶液与0.1mol/L?HCl溶液等体积混合,则溶液中N2H+5、Cl-、OH-、H+离子浓度由大到小的顺序为______.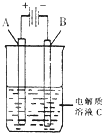
参考答案:(1)16.0g肼的物质的量=16g32g/mol=0.5mol,0.5molN2H4在氧气中完全燃烧生成氮气放出热量312kJ,则1mol肼在氧气中完全燃烧放热的热量为624KJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;燃料电池中负极上投放的是燃料肼,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H2+4OH--4e-=4H2O+N2;反应过程中生成水导致溶液中氢氧根离子浓度减小,所以溶液的pH值变小.
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;N2H2+4OH--4e-=4H2O+N2;减小;
(2)电解食盐水的方程式为:2NaCl+2H2O?电解?.?2NaOH+Cl2↑+H2↑,根据方程式知,阴阳极上生成的气体物质的量相等,即体积也相等,所以生成氢气的体积是0.56L,生成0.56L氢气同时生成氢氧化钠的物质的量=0.56L22.4L/mol×2=0.05mol,氢氧化钠的物质的量浓度=0.05mol0.5L=0.1mol/L,氢离子浓度为10-13 mol/L,所以溶液的pH=13;
根据得失电子数相等,生成0.56L氢气转移的电子数与空气中氧气转移的电子数相等,设空气的体积为XL.
0.56L×2=0.2XL×4,X=1.4.
故答案为:13;1.4;
(3)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,
电离方程式为N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-.
故答案为:N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-;
(4)常温下,混合溶液的pH=6,溶液显酸性,则酸电离产生的氢离子大于水电离产生的氢离子,由水电离出的
c(H+)为10-8mol/L,0.1mol/LHCl溶液中由水电离出的c(H+)为10-140.1=10-13mol/L,
故答案为:大于;
(5)将0.2mol/L?N2H4?H2O溶液与0.1mol/L?HCl溶液等体积混合,得到等量的N2H4?H2O、N2H5C1,由相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度,则c(N2H+5)>c(Cl-),又溶液显碱性,即c(OH-)>c(H+),电离、水解的程度都不大,所以c(N2H5+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
本题解析:
本题难度:一般