1、选择题 下列各组离子在指定条件下,能大量共存的是
[? ]
①在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
②使pH试纸变深蓝的溶液中:K+、CO32-?、Na+、AlO2-
③水电离的c(H+)=10-13?mol/L的溶液中:ClO-、CO32-?、NO3-、NH4+、SO32-?
④在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-?
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-?、Na+、Fe3+
⑥能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
A.①③ ?
B.②⑤?
C.①②⑤ ?
D.③⑥
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列各组物质反应中,溶液的导电性比反应前明显增强的是(? )
A.向亚硫酸钠溶液中加液溴
B.向硝酸银溶液中通入少量氯化氢
C.向氢氧化钠溶液中通入少量氯气
D.向硫化氢饱和溶液中通入少量氯气
参考答案:D
本题解析:A、B、C三种溶液均为强电解质溶液,导电能力较强,加入物质反应后,仍为强电解质溶液,导电能力变化不大。而D项硫化氢饱和溶液属弱电解质溶液,通入氯气后,发生氧化还原反应生成HCl(强电解质),使溶液中自由移动的离子浓度增大,故导电能力明显增强。
本题难度:简单
3、选择题 常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH="1"
D.室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:C
本题解析:解:(NH4)2SO4溶液中硫酸根离子对铵根离子水解无影响,(NH4)2Fe(SO4)2和溶液中亚铁离子水解显酸性抑制铵根离子的水解,NH4Cl溶液中氯离子对铵根离子无影响,当铵根离子浓度相同时溶质浓度应为,c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2],故A错误;依据一定温度下沉淀溶解平衡中存在溶度积常数,依据溶度积和沉淀溶解平衡,计算银离子最大浓度;Ksp(AgCl)=1.8×10-10,0.1mol·L-1AlCl3溶液中c(Cl-)为0.3mol·L-1,Ksp(AgCl)=c(Ag+)×c(Cl-)=c(Ag+)×0.3mol·L-1=1.8×10-10;c(Ag+)=6×10-10mol·L-1;故B正确;0.2mol·L-1 HCl溶液与等体积0.05mol·L-1 Ba(OH)2溶液混合后,依据溶液中溶质物质的量分析判断,酸过量,设酸碱溶液体积为1L,盐酸溶液中氢离子物质的量为0.2mol,氢氧化钡溶液中氢氧根离子物质的量为0.1mol,所以混合溶液中c(H+)= 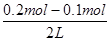 =0.05mol·L-1,溶液的pH=-lg0.05=2-lg5,故C错误;0.1mol·L-1 NaHA溶液的pH=4,溶液呈酸性,说明酸式酸根离子的电离程度大于水解程度,溶液中的离子浓度大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A);故D正确;故选C。
=0.05mol·L-1,溶液的pH=-lg0.05=2-lg5,故C错误;0.1mol·L-1 NaHA溶液的pH=4,溶液呈酸性,说明酸式酸根离子的电离程度大于水解程度,溶液中的离子浓度大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A);故D正确;故选C。
本题难度:一般
4、选择题 在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
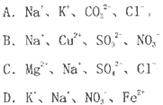
参考答案:C
本题解析:A、酸性溶液中H+与CO32-不能大量共存,错误;B、Cu2+是蓝色离子,同时酸性溶液中SO32-与NO3-发生氧化还原反应,不能大量共存,错误;C、酸性溶液中各离子都不反应,可以大量共存,正确;D、Fe2+有颜色,且在酸性条件下与NO3-发生氧化还原反应,不能大量共存,错误,答案选C。
本题难度:一般
5、选择题 某同学对一无色透明溶液进行分析,得出该溶液中含有下列某组离子,你认为该组离子应是 (? )
A.Ca2+、H+、HCO3ˉ、Na+
B.Al3+、NO3ˉ、K+、SO42ˉ
C.OHˉ、CO32-、Ca2+、SO42ˉ
D.Fe3+、Mg2+、NO3ˉ、Clˉ
参考答案:B
本题解析:略
本题难度:一般