1、选择题 下列除去杂质的方法错误的是
[? ]
物质?
杂质
试剂
主要操作
A.
SiO2?
Fe2O3
盐酸
过滤
B.
Mg?
Al
NaOH
过滤
C.
FeCl2?
FeCl3
Cu
过滤
D.
KNO3
KCl
H2O
冷却结晶
参考答案:C
本题解析:
本题难度:一般
2、简答题 (1)请指出下列做法中分别应用了哪些分离方法?(过滤、蒸发、蒸馏、萃取、结晶)
a、熬煮中药______?b、分离豆浆和豆渣______c、用海水晒盐______?d、海水淡化______
(2?)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol.
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g.
根据上述实验回答:
(a)原溶液中一定不存在的离子是______.
(b)原溶液中可能存在的离子是______.
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度______.
参考答案:(?1?)熬煮中药用的是萃取的方法进行分离;豆渣不能透过滤纸,可用过滤的方法分离;用海水晒盐用的是蒸发的方法分离;可通过蒸馏的方法进行海水淡化,
故答案为:萃取;过滤;蒸发;?蒸馏;
(?2?)(?a?)?第一份加入足量NaHCO3溶液后,收集到气体0.03mol,说明溶液呈酸性,则存在H+离子,不存在CO32-离子,根据溶液的电中性原则,则一定含有SO42-,
那么,就不可能存在Ba2+,故答案为:Ba2+、CO32-;
(?b?)根据H++HCO3-=H2O+CO2↑,则有n(H+)=n(CO2)=0.03mol,第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g,该沉淀为BaSO4,则有
n(SO42-)=n(BaSO4)=4.66g233g/mol=0.02mol,根据溶液电中性原则可知溶液中还应有?K+、Mg2+离子中的至少一种,
故答案为:K+、Mg2+;
(c?)n(SO42-)=n(BaSO4)=4.66g233g/mol=0.02mol,则c(SO42-)=0.02mol0.1L=0.2mol/L,故答案为:0.2?mol/L.
本题解析:
本题难度:一般
3、简答题 铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:
①4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O32NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______. | 物质 | 溶解度/(g/100g水)
0°C
40°C
80°C
KCl
28
40.1
51.3
NaCl
35.7
36.4
38
K2Cr2O7
4.7
26.3
73
Na2Cr2O7
163
215
376
|
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n?g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m?g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如下:
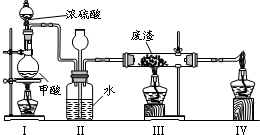
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是______.
参考答案:(1)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO?Cr2O3+8Na2CO3+7O2750℃
本题解析:
本题难度:一般
4、实验题 (9分)某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物。
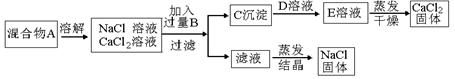
(1)B溶液是?,加入过量B溶液的原因是?,
反应的离 子方程式是?。
子方程式是?。
(2)经此实验方法分离得到的NaCl,经分析含有杂质,若要得到纯净的NaCl,还应补充的实验操作步骤是:?
(3)若要测定该 混合物中NaCl和CaCl2的质量比,可称量干燥的C沉淀的质量(设为m1)和混合物A的质量(设为m2)来确定
混合物中NaCl和CaCl2的质量比,可称量干燥的C沉淀的质量(设为m1)和混合物A的质量(设为m2)来确定 ,混合物中NaCl和CaCl2的质量比为?(用m1、m2表示)
,混合物中NaCl和CaCl2的质量比为?(用m1、m2表示)
参考答案:(共9分)
(1)Na2CO3 (1分),使Ca2+沉淀完全(1分),Ca2++CO32-===CaCO3↓。(2分)?
(2)加入了过量的Na2CO3 (1分),滤液中加入足量盐酸(共9分)。
(3) (1+2分) 
本题解析:略
本题难度:一般
5、选择题 向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生。该溶液含有
A.CO32―
B.OH―
C.SO42―
D.HCO3―
参考答案:C
本题解析:向某溶液中加入稀HNO3酸化的BaCl2溶液,有白色沉淀产生,则该溶液中一定含有SO42―,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该类试题学生需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单