1、填空题 (14分)合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为?L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)?
CO2(g)+H2(g)?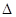 H=-41.16kJ/mol,对于该反应有关表述正确的是?。
H=-41.16kJ/mol,对于该反应有关表述正确的是?。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为?(保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为?,碳酸氢钾溶液中离子浓度大小顺序为?
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应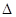 H ?0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?。
H ?0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理?。
参考答案:(14分,每空2分)(1)17.92L
(2)b d? 2.0
(3)10-4mol/L?[K+]>[HCO3]>[OH]>[H+]
(4)<?净化后重新充入合成塔内,循环利用,提高原料利用率
本题解析:(1)甲烷在一定条件下与水反应的方程式为CH4+H2O→CO+3H2,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为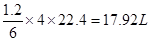 。
。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该体系温度不再改变,说明此时正逆反应速率相等,即达到平衡状态,b正确。正反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,c不正确。增加水蒸气用量虽然可降低自身的转化率,但会提高其它反应物的转化率,d正确。
(3)碳酸钾水解显碱性,促进了水的电离,所以下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为1×10-4mol/L。碳酸氢钾溶液显碱性是因为碳酸氢钾的水解程度大于其电离程度,所以溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
(4)由图像可看出,在等压时温度越高,二氧化碳的转化率越低,所以正反应是放热反应。为了提高原料的利用率,必须循环使用。
本题难度:一般
2、选择题 下列反应中属吸热反应的是
A.铝与盐酸反应放出氢气
B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧
D.Ba(OH)2·8H2O与NH4Cl反应
参考答案:D
本题解析:A、B、C都是放热反应,D是吸热反应,答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是记住常见的放热反应和吸热反应,即一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。
本题难度:简单
3、选择题 下列变化过程中,需要吸热的是(? )
A.生石灰与水混合
B.天然气燃烧
C.浓硫酸溶于水
D.干冰气化
参考答案:D
本题解析:A、B、C都是放热的,干冰气化需要吸热,答案选D。
点评:需要吸热或放热的过程不一定是吸热反应或放热反应,因为只有在化学反应中才能分放热反应或吸热反应。
本题难度:简单
4、选择题 下列反应属于放热反应的是
A.氢气还原氧化铜
B.氢气在氧气中燃烧
C.Ba(OH)2·8H20与NH4Cl反应
D.碳酸钙高温分解成氧化钙和二氧化碳
参考答案:B
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以正确都答案是B。
本题难度:简单
5、选择题 天然气燃烧过程中的能量转化方式为
A.热能转化为化学能
B.化学能转化为电能
C.化学能转化为热能
D.化学能转化为机械能
参考答案:C
本题解析:天然气是一种燃料,具备化学能,燃烧过程中主要转化为热能,应该为化学能转化为热能,C选项正确。A.热能转化为化学能的实例---太阳光分解水;B.化学能转化为电能的实例原电池装置;D.化学能转化为机械能最典型的实例就是内燃机工作原理。故选C。
点评:本题考查能量转化方式。难度不大,记住以上几种转化形式,可以迎刃而解。
本题难度:一般