1、选择题 常温下,下列对有关溶液的判断不正确的是
[? ]
A.NaA溶液的pH =8,c(Na+) -c(A-) =0.99×10-6mol/L
B.Na2CO3溶液中,c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
C.温度相同、浓度相同的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3 ⑤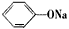 ⑥CH3COONa
⑥CH3COONa
溶液,它们的pH由小到大的顺序是:①③④②⑥⑤
D.10 mL pH= 12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液体积v总≤20mL
2、选择题 常温下,有下列4种溶液:

下列说法正确的是
[? ]
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液显酸性,则溶液中离子浓度:c(CH3COO-)>c(Na+)
3、选择题 下列盐的水溶液,其pH值小于7的是( )
A.NH4Cl溶液
B.NaCl溶液
C.Na2SO4溶液
D.NaHCO3溶液
4、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA- HA- H+ + A2-
H+ + A2-
回答下列问题:
?(1)用离子方程式表示Na2A溶液显"酸性""或中性"或"碱性"的原因 __________________________________________
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B.c(OH-)=c(H+) +c( HA-)+2c(H2A)
C.c(Na+)+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D.c(Na+ ) >c(A2-)>c( HA-) >c(OH-) >c(H+)
(3)常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应___________ 0.1mol/L(填">"或"<"或"="); 理由是_______________________________。
(4)比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①_________ ②(填">"或"<"或"=")。
5、选择题 下列溶液蒸干后得到的固体,仍是原溶质的是( )
A.K2CO3溶液
B.Na2SO3溶液
C.Ca(HCO3)2溶液
D.FeCl3溶液