|
高考化学知识点整理《氯及其化合物》答题技巧(2019年最新版)(二)
2019-05-30 03:23:33
【 大 中 小】
|
1、选择题 下列关于氯水的叙述,正确的是
A.新制氯水中只含有Cl2、H2O和H+三种微粒
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后酸性减弱
参考答案:B
本题解析:A、氯气溶于水即得到氯水,在新制氯水中含有Cl2、H2O、HClO、Cl-、ClO-、OH-和H+六种微粒,A不正确;B、新制氯水显酸性,同时还具有强氧化性,因此新制氯水可使蓝色石蕊试纸先变红后褪色,B正确;C、氯水中的次氯酸不稳定,受热易分解生成氯化氢和氧气,因此光照氯水有气泡逸出,该气体是氧气,C不正确;D、氯水中的次氯酸不稳定,受热易分解生成氯化氢和氧气,因此氯水放置数天后酸性增强,D不正确,答案选B。
本题难度:一般
2、选择题 氯气通入石灰乳制得漂白粉,其主要成分是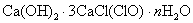 ,一定质量的漂白粉和一定浓度的盐酸完全反应,生成 ,一定质量的漂白粉和一定浓度的盐酸完全反应,生成 的质量与参加反应的漂白粉质量之比可标志“有效氯”的多少。如果某漂白粉测其“有效氯”的质量分数为35%,该漂白粉的组成和上述化学式相符时,求式中的n值是( ) 的质量与参加反应的漂白粉质量之比可标志“有效氯”的多少。如果某漂白粉测其“有效氯”的质量分数为35%,该漂白粉的组成和上述化学式相符时,求式中的n值是( )
A.0.5
B.8
C.8.5
D.10
|
参考答案:C
本题解析:考查对于氯气化学性质的掌握。学生往往不清楚漂白粉与盐酸反应实质而导致错误。
?题给信息有:①漂白粉的化学式: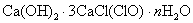 ;②有效氯 ;②有效氯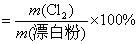
该漂白粉与盐酸反应的化学方程式为:
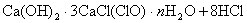 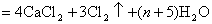
?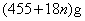 ?3×71 ?3×71
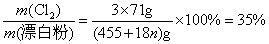

本题难度:一般
3、实验题 (11分)
下图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图:
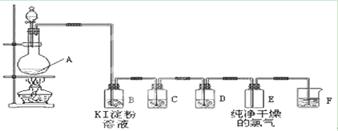
(1)反应前,在装置A中?装浓盐酸(填写仪器名称)
??装MnO2(填写仪器名称)
装置A中反应的化学方程式为 ?。
(2)装置B中的现象是??
反应的化学方程式为 ?。
(3)装置D中所装试剂是??,作用是??。
(4)装置F中发生反应的离子方程式为??
参考答案:(共11分)
(1)分液漏斗(1分)?圆底烧瓶(1分)
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分) MnCl2+Cl2↑+2H2O(2分)
(2)溶液变蓝(1分)? Cl2 + 2KI =" 2KCl" + I2(2分)
(3)浓硫酸(1分)?吸收水分(干燥气体)(1分)
(4)Cl2 + 2OH- =Cl- +ClO- +H2O(2分)
本题解析:(1)反应前,在装置A中分液漏斗装浓盐酸;圆底烧瓶装MnO2?;装置A中反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。 MnCl2+Cl2↑+2H2O。
(2)氯气会和装置B中的碘化钾反应会生成碘单质,所以现象是溶液变蓝;
反应的化学方程式为Cl2 + 2KI =" 2KCl" + I2。
(3)装置D中所装试剂是浓硫酸 ,作用是吸收水分(干燥气体)。
(4)装置F是尾气的处理装置,应盛放氢氧化钠,所以装置F中发生反应的离子方程式为Cl2 + 2OH- =Cl- +ClO- +H2O。
点评:此题要求学生熟练掌握氯气的相关性质及实验室条件下制备方法。实验室制取氯气的方法和步骤如下:
(1)仪器设备:铁架台、酒精灯、石棉网、园底烧瓶、分液漏斗配双孔塞、导气管、集气瓶、小烧杯
(2)试剂:氢氧化钠溶液、浓盐酸、二氧化锰
(3)步骤:(A)把装置连接好,检查气密性
(B)在烧瓶中加入少量二氧化锰,从分液漏头里慢慢地注入密度为1。19的浓盐酸
(C)缓缓加热,使反应加快,有氮气均匀放出。
(D)用向上排空气法收集
(E)多余氮气用氢氧化钠吸收。
本题难度:一般
4、选择题 下列说法不正确的是
A.欲提高氯水中HClO的浓度可往氯水中加适量的碳酸钙粉末
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.氯气泄漏,自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
参考答案:C
本题解析:因氯气的密度大于空气的密度,故应向地势高的地方撤离,错误。
本题难度:一般
5、填空题 (6分)氯水中含有多种成分,因而具有多得性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。能证明氯水具有漂白性的是??(填“a”、“b”、“c”或“d”)。C过程中的现象是 ?,b过程中的离子方程式为??。a过程中的化学方程式为 ?。
 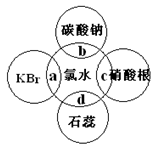
参考答案:d, 有白色沉淀生成 2H++CO32-=H2O+CO2,2Br-+Cl 2=2Cl- + Br2
本题解析:氯水中的HClO有强氧化性,一般在应用其漂白时,HClO的强氧化性将有色物质氧化成无色物质,本题中氯水能使石蕊试液先变红,后褪色,故答案为:d;氯水中有Cl-,加入AgNO3溶液有白色沉淀生成,生成AgCl沉淀,故答案为:有白色沉淀生成;氯水中含有HCl和HClO,具有酸性,与CO32-反应生成二氧化碳气体,反应的离子方程式为CO32-+2H+=CO2↑+H2O,Cl2是新制氯水的主要成分,具有强氧化性,与KBr发生氧化还原反应,反应的化学方程式为2KBr+Cl2 ═2KCl+Br2,故答案为:CO32-+2H+=CO2↑+H2O; 2KBr+Cl2 ═2KCl+Br2。
点评:本题考查氯气的性质,题目难度不大,注意氯水的成分和性质,注重基础知识的积累。
本题难度:一般
|