1、选择题 实验室制备下列气体时,所用方法正确的是
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
参考答案:A
本题解析:A、Na2O2与H2O反应、H2O2在MnO2催化条件下都能制取O2,二者都是固体与液体反应,可选用相同的气体发生装置,正确;B、实验室制取氯气含有HCl和水分,常用饱和食盐水和浓硫酸净化气体,错误;C、乙烯的密度与空气比较接近,不能用排空气法收集,错误;D、二氧化氮与H2O反应生成一氧化氮,仍然能污染空气,所以不能用水吸收,错误。
本题难度:一般
2、选择题 下列实验操作完全正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.从钠的保存环境和钠与水反应的剧烈程度考虑;
B.严格按配制一定物质的量浓度的步骤来判断正误,不能直接在容量瓶中进行;
C.滴定管中气泡的排除方法为将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡;
D.分液时,下层液体从下口流出,上层液体只能从上口倒出.
解答:A.因钠保存在煤油中,表面有覆盖的煤油,所以应用滤纸吸去表面的煤油,钠与水反应剧烈,水的量也不应太多,故A错误;
B.配制步骤为称量、溶解、转移、定容等步骤,不能直接在容量瓶中进行,故B错误;
C.将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡,故C正确;
D.分液时,下层液体从下口流出,上层液体只能从上口倒出,若从下口流出,会混有下层液体,故D错误.
故选C.
点评:本题考查实验基本操作,熟练掌握基本操作,是做好此类题目的前提,题目难度不大.
本题难度:简单
3、填空题 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
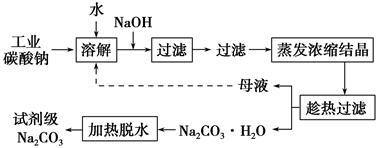
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下:
物质
| CaCO3
| MgCO3
| Ca(OH)2
| Mg(OH)2
| Fe(OH)3
|
Ksp
| 4.96×10-9
| 6.82×10-6
| 4.68×10-6
| 5.61×10-12
| 2.64×10-39
|
?
回答下列问题:
(1)加入NaOH溶液时发生反应的离子方程式为:_____________________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“趁热过滤”时的温度应控制在________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由________________________________________。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH=+473.63 kJ·mol-1
写出NaCO3·H2O脱水反应的热化学方程式________________________________________。
参考答案:(1)Fe3++3OH-=Fe(OH)3↓、MgCO3+2OH-=Mg(OH)2+CO32-、Mg2++2OH-=Mg(OH)↓(三个答对两个即可) 2.125×1021
(2)高于36 ℃
(3)不可行 若“母液”循环使用,则溶液中c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
(4)Na2CO3·H2O(s)=Na2CO3(s)+H2O(g)ΔH=+58.73 kJ·mol-1
本题解析:(1)根据表中数据,结合题意可知加入NaOH溶液时Mg2+、Fe3+分别与OH-结合生成沉淀Mg(OH)2和Fe(OH)3。(2)温度越高碳酸钠晶体的溶解度越大,为了减少碳酸钠的损失,故应趁热过滤,根据题中所给数据,在温度高于36 ℃析出晶体最少。(3)“母液”沿流程中虚线所示进行循环使用时,会造成Cl-和SO42-等离子的富集,使所得产品中含有杂质。
(4)将两个已知的热化学方程式按顺序编号为①②,根据盖斯定律①-②得Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73 kJ·mol-1。
本题难度:一般
4、选择题 下列实验能达到预期目的的是
A.从含I-的溶液中提取碘:加入硫酸酸化的H2O2溶液,再用酒精萃取
B.检验溶液中是否一定含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
C.检验蔗糖水解产物是否有还原性:向水解后的溶液中加入新制Cu(OH)2并加热
D.除去粗盐溶液中的Ca2+、SO42-:依次加入过量的BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸
参考答案:D
本题解析:从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,应用CCl4萃取,不能用酒精萃取,酒精与水互溶;A选项不正确,检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水,可能有HCO3-、SO32-、HSO3-等干扰;B选项不正确,检验蔗糖水解产物:向蔗糖溶液中加入适量稀硫酸水浴加热后,应先加NaOH中和到中性或弱碱性,再加入新制的Cu(OH)2悬浊液,加热至沸腾。C选项不正确,除去粗盐中的Ca2+、SO42-及泥沙,盐酸要放在最后,来除去过量的碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子.D选项正确。
本题难度:一般
5、选择题 下列物质可用重结晶法提纯的是
A.含杂质的工业酒精
B.含杂质的粗苯甲酸
C.从溴水中提纯溴
D.苯中混有少量苯酚
参考答案:B
本题解析:略
本题难度:简单