1、选择题 保持洁净安全的生存环境已成为全人类的共识。
⑴某地河流中含有大量的重金属离子,我们常采用?法除去。
⑵天然水中含有的细小悬浮颗粒可以用明矾做?剂进行净化处理,明矾水解得到的?可以吸附细小悬浮颗粒。
⑶为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是在煤炭中加入石灰石粉末对化石燃料进行?处理,其原理用方程式可表示为?。
参考答案:(1)沉淀法(1分) (2) 混凝(1分);Al(OH)3胶体(1分)
(3)脱硫处理(1分)?
2CaCO3+2SO2+O2 2CaSO4+2CO2(2分)(写为两步或三步反应均给分)
2CaSO4+2CO2(2分)(写为两步或三步反应均给分)
本题解析:(1)废水中的重金属离子,利用来沉淀法除去,故答案为:沉淀法;?
(2)明矾可作混凝剂,电离产生Al3+、Al3+水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,故答案为:混凝;Al(OH)3胶体;
(3)向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,反应的方程式为2CaCO3+2SO2+O2 2CaSO4+2CO2,故答案为:脱硫;2CaCO3+2SO2+O2
2CaSO4+2CO2,故答案为:脱硫;2CaCO3+2SO2+O2 2CaSO4+2CO2。
2CaSO4+2CO2。
本题难度:一般
2、选择题 在食品加工或餐饮业中,使用量要严加控制的物质是
A.亚硝酸钠
B.味精
C.小苏打
D.氯化钠
参考答案:A
本题解析:亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐对人体有害,可使血液中的低铁血红蛋白氧化成高铁血红蛋白,失去运输氧的能力而引起组织缺氧性损害。亚硝酸盐不仅是致癌物质,而且摄入0.2-0.5g即可引起食物中毒,3g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。鉴于亚硝酸盐对肉类腌制具有多种有益的功能,现在世界各国仍允许用它来腌制肉类,但用量严加限制。
本题难度:一般
3、选择题 十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”。化学已渗透到人类生活的各个方面。下列说法正确的是
A.PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响
B.垃圾是放错地方的资源,应分类回收利用
C.高纯度的硅单质广泛用于制作光导纤维,光导纤维是新型高分子非金属结构材料
D.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油
参考答案:B
本题解析:PM2.5大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒,其直径不在1nm~100nm之间,不能形成胶体,PM2.5可直接侵入人体,戴普通口罩基本无用,A选项不正确;B选项正确,制作光导纤维的材料应是二氧化硅,不是单晶硅,C选项不正确,“地沟油”中含有许多对人体有害的物质,所以禁止食用。但地沟油属于酯类物质,在碱性条件下水解产生高级脂肪酸钠和甘油。高级脂肪酸钠就是肥皂的主要成分,故仍可以用来制肥皂。D选项不正确。
本题难度:一般
4、填空题 汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)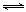 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
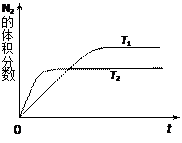
⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)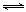 2NO(g)为?(填“吸热”或“放热”)反应。
2NO(g)为?(填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K=?。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为?。
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
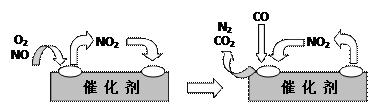 ?
?
写出上述变化中的总化学反应方程式:?。
参考答案:⑴吸热? ⑵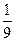 ?(0.11)? 14.3%? ⑶2NO+O2+4CO
?(0.11)? 14.3%? ⑶2NO+O2+4CO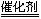 4CO2+N2
4CO2+N2
本题解析:根据图像T2温度可逆反应先达平衡,说明温度:T2>T1,T1向T2转变,即升温过程中,N2的体积分数减小,说明平衡正向移动,即正向为吸热反应
本题难度:一般
5、选择题 今年3月修订的《环境空气质量标准》中新纳入的强制监测指标是?
[? ]
A.PM2.5?
B.NOx?
C.SO2?
D.可吸入颗粒物
参考答案:A
本题解析:
本题难度:简单