1、填空题 (12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是?;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈?____ 形,该分子属于?分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______?__________________。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
?
| ?
| A-B
| A=B
| A≡B
|
CO
| 键能(kJ/mol)
| 357.7
| 798.9
| 1071.9
|
键能差值kJ/mol)
| ? 441.2? 273
|
N2
| 键能(kJ/mol)
| 154.8
| 418.4
| 941.7
|
键能差值kJ/mol)
| ? 263.6? 523.3
|
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为?_____?。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于?____(填晶体类型);Fe(CO)5是配合物,配体是__________?。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、?___、?____?等仪器。
步骤2中,改用试剂?_______?(写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是?。
步骤3中,滴定过程中,眼睛应注视?____________________,被滴定的20 mL滤液中含CO32-的物质的量为? __?mol,试计算原500g茶叶中钙离子的质量分数为?_______?,计算过程如下:
参考答案:
A.(1)Ar (1分)?E是CH3OH,CH3OH形成分子间氢键(1分)
(2)V形(或角形或其他合理答案),(1分)极性分子。(1分)
(3)N2O4 + 2N2H4 = 3N2 + 4H2O(2分)
(4)CO中第一个π键的键能比N2的小很多,CO的第一个键容易断。(1分)
(5)1,2(2分)
(6)3d84s2(1分),分子晶体(1分),CO(1分)。
B.步骤1:坩埚、坩埚钳(每空1分,共2分)
步骤2:氨水(2分)
取最后一次洗涤液少许于试管中,滴加CaCl2溶液(其他合理的答案等均可),若无沉淀产生,则已洗净。(2分,其他合理答案均给分)
步骤3:锥形瓶内溶液颜色变化和滴定管内液体流出速率。(2分,只答前者也给分)
0.001 (1分)? 0.4%(或0.004)(1分)
计算过程:(2分)
步骤2所得的滤液中含CO32-的物质的量为0.001mol×500÷20=0.025mol
7.95g无水碳酸钠的物质的量为7.95g÷106g/mol=0.075mol
原500g茶叶中钙离子(实验中转化为CaCO3) 的物质的量
=转化为CaCO3的CO32-的物质的量=0.075mol-0.025mol=0.050mol
原500g茶叶中钙离子的质量分数=0.050mol×40g/mol÷500g=0.004
本题解析:略
本题难度:简单
2、选择题 下列说法正确的是
A.苯分子中含有三个碳碳双键
B.将乙酸和乙醇混合加热即可制取乙酸乙酯
C.葡萄糖能够发生银镜反应
D.糖类、油脂、蛋白质均能发生水解
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (12分)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。

 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是?▲?(填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是?▲?。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为?▲?。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有?▲?。
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为?▲?;该晶体的化学式为?▲?。
参考答案:⑴O
⑵NH3分子间能形成氢键
⑶sp
⑷孤对电子
⑸6? MgNi3C
本题解析:略
本题难度:一般
4、选择题 S2Cl2是橙黄色液体,少量泄漏会产生室息性气味的气体,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法错误的是

[? ]
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
参考答案:A
本题解析:
本题难度:一般
5、简答题 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
| A | B | C | D | E | F | G | H | I | J
原子半径(10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
0.102
0.037
|
最高或最低
化合价
+2
+1
+5
+7
+1
+5
+3
+6
+1
-2
-3
-1
-3
-2
|
回答下列问题:
(1)D的元素名称是______,H的元素符号是______.
B在元素周期表中的位置是(周期、族)______
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______.
化合物F2A2的电子式是:______,构成该物质的化学键类型为______
(3)用电子式表示A的简单氢化物的形成过程如下:______;G的氢化物的结构式为______.
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6kJ热量,写出其热化学方程式______.
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:______.
参考答案:从图表数据可知,+1价的C、F,一定是碱金属Li和Na,而原子半径F>C,故C应为IA族第二周期的Li,F为三周期的Na元素,J为H元素;D和G最高正价均为+5,负价一致,故为VA族元素,因原子半径D>G,故D为第三周期第VA族的P元素,G为N元素;从化合价可推出E属于卤素,由于短周期F元素无正价,故E为氯元素,位于第VIIA族第三周期;H最高正价+3价,无负价,只能是IIIA族元素,而原子半径H>F,故H只能是位于第二周期第IIIA族的B元素;A和I的最低负价都为-2价,I最高正价为+6价,则A应为第二周期的O元素,I为第三周期的S元素.
(1)由以上分析可知,D为P元素,F为B元素,B为Mg元素,位于第三周期ⅡA族,故答案为:磷;B;第三周期?第ⅡA族;
(2)以上元素中,非金属性最强的元素为Cl元素,对应的最高价氧化物的水化物的为HClO4,酸性最强,化合物F2A2为Na2O2,为离子化合物,含有离子键和非极性共价键,
故答案为:HClO4;
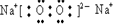
;离子键、非极性键;
(3)A的简单氢化物为H2O,用电子式表示的形成过程为
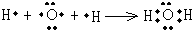
,G的氢化物为NH3,其结构式为
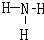
,
故答案为:
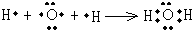
;
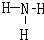
;
(4)IA2气体与足量的A单质充分反应为2SO2+O2

2SO3,
n(SO3)=20g80g/mol=0.25mol,
生成2molSO3放出的热量为:24.6kJ×8=196.8?kJ,
反应的热化学方程式为2SO2?(g)+O2(g)

2SO3(g);△H=-196.8?kJ/mol,
故答案为:2SO2?(g)+O2(g)

2SO3(g);△H=-196.8?kJ/mol;
(5)碱性氢氧燃料电池中,负极发生氧化反应,氢气得电子生成氢氧根离子,电极反应式为H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
本题解析:
本题难度:一般