1、选择题 X、Y、Z、W有如图所示的转化关系,且△H=△H1+△H2,则X、Y可能是
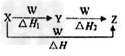
[? ]
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤
B.②④⑤
C.①③④?
D.①②③
参考答案:C
本题解析:
本题难度:一般
2、选择题 为了除去FeCl2溶液中混有的少量FeCl3杂质,最好的方法是向此溶液中( )
A.通入足量氯气
B.加入足量稀硝酸
C.加入足量Fe粉
D.加入足量Cu粉
参考答案:C
本题解析:
本题难度:一般
3、简答题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是______.
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______.
(3)操作IV的顺序依次为:______、结晶______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L?KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4?7H2O的质量分数为______.
②若用上述方法测定的样品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有______;______.
参考答案:(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
故答案为:取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+;
(2)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,
故答案为:使Sn2+完全变成SnS沉淀,而Fe2+不沉淀;防止Fe2+的氧化;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,故答案为:蒸发、过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4?7H2O的损耗;
(5)①a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式减小计算:
? 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
? 5? 1
? n(Fe2+)? 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×25025=0.01mol;
FeSO4?7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=2.78g2.85g×100%=97.54%;
故答案为:97.54%;
②用上述方法测定的样品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,
故答案为:样品中存在少量的杂质(如H2O、H2SO4等);样品部分被氧化.
本题解析:
本题难度:一般
4、填空题 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成
FeCl2和CuCl2。某校学习 探究小组对“腐蚀液”腐蚀后的废液进行处理,以回收铜和再生氯化铁。
(1)小组内部分同学提出FeCl3溶液是否都转化为FeCl2了,须要进行检验,其方法是? 。
(2)回收铜和再生氯化铁的设计方案如下:
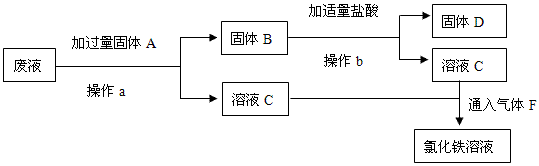
①操作a的名称是? ,固体B的化学式为? 。
②写出通入气体F时发生反应的离子方程式? 。
(3)FeCl3溶液不仅能作印刷电路板的“腐蚀液”,还能作净水剂,其原因是? 。
参考答案:(1)取废液少许注入试管中,滴加KSCN溶液,若变血红色,则表明还含有Fe3+,否则不含Fe3+。
(2)①过滤;Fe、Cu
? ②2Fe2++Cl2==2Fe3++2Cl-
(3)氯化铁溶于水时会形成胶体,故有净水作用。
本题解析:
本题难度:一般
5、选择题 制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.有Cu无Fe
B.有Fe无Cu
C.Fe、Cu都有
D.Fe、Cu都无
参考答案:B
本题解析:
本题难度:简单