1、选择题 如图表示1~18号元素原子的结构或性质随核电荷数递增的变化。图中纵坐标表示
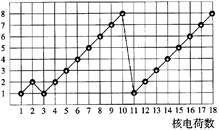
A.电子层数
B.原子半径
C.最高化合价
D.最外层电子数
参考答案:D
本题解析:电子层数原子序数1-2的相同,原子序数3-10相同,原子序数11-18相同,很显然A选项错误,同周期主族元素,随原子序数递增原子半径减小,B选项错误,第二周期氧、氟两元素没有最高正价,C选项错误,D选项正确。
本题难度:简单
2、选择题 下列各组中两种微粒所含电子数不相等的是
A.H3O+和OH-
B.CO和N2
C.HNO2和NO2-
D.CH3+和NH4+
参考答案:D
本题解析:A、H3O+和OH-均含有10个电子,A不正确;B、CO和N2均含有14个电子,B不正确;C、HNO2和NO2-均含有24个电子,C不正确;D、CH3+中含有8个电子,而NH4+含有10个电子,D正确,答案选D。
本题难度:简单
3、填空题 有4种元素:xA、yB、zC、uD,其中B的负二价离子和C的正一价离子均具有氩原子相同的核外电子排布,又已知x+y+z+u=64,u=x+5,根据以上条件进行推断:
(1)A原子的结构示意图?,C+的离子结构示意图:?。
(2)写出元素B的氢化物和D的单质之间发生置换反应的化学方程式:?。由此得出元素B、D的单质的氧化性B?D(填“>”、“<”)。
(3)A和D组成的化合物化学式是?,其中阳离子与阴离子的电子层数相差?。
参考答案:(1)Mg原子结构示意图(2分);K+离子结构示意图(2分)。
(2)H2S+Cl2===2HCl+S(2分)。B<D(2分)。(3)MgCl2(2分),1(2分)。
本题解析:略
本题难度:简单
4、选择题 核反应堆通常使用235U和239Pu作为原料,研究和开发核能可以减少对化石燃料的依赖。下列有关说法正确的是
A.239Pu比235U原子核内多4个中子
B.核反应堆中使用的重水与水互为同位素
C.石油、天然气等化石燃料属于可再生能源
D.合理使用核能可有效减少温室气体的排放
参考答案:D
本题解析:A项239Pu比235U的质子数不等,其原子核内中子数相差不等于4,错误;B项重水与水均为水分子,不是同位素关系,错误;C项石油、天然气等化石燃料不属于可再生能源,错误。
本题难度:一般
5、选择题 短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是(?)
A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子
B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
参考答案:A
本题解析:① R、Y原子的最外层电子数与电子层数相同,可知R是H元素,由②知Q是O元素;则T是N元素;③W与R同主族,则W是Na元素,Y原子的最外层电子数与电子层数相同,且原子序数比W大的短周期元素是Al,所以Y是Al元素。A、O与Na形成的氧化钠与过氧化钠中阴阳离子个数比都是1:2,正确;B、根据原子半径的比较规律,元素T、Q、W、Y的原子半径大小为:Q<T<Y<W,错误;C、O与Al形成的化合物氧化铝中只有离子键,错误;D、氮化铝是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在高温下合成,错误,答案选A。
本题难度:一般