1、简答题 已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成四核10电子分子.试回答下列问题:
(1)写出下列元素的符号A______,B______,C______;
(2)写出D元素形成的单质的结构式______;
(3)写出下列物质的电子式:E2B2______;D、E形成的化合物______;A、B、E形成的化合物______.
(4)A、B两元素组成的化合物A2B2属于______(“离子”“共价”)化合物,存在的化学键是______.
参考答案:五种短周期元素的原子序数的大小顺序为C>A>B>D>E.A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30,则离子含有的电子数为10,由A2B可知,A离子为+1价离子,B离子为-2价离子,则A为钠元素,B为氧元素;B、C同主族,则C为硫元素;D和E可形成四核10电子分子,则D为氮元素,E为氢元素.
故A为钠元素,B为氧元素,C为硫元素,D为氮元素,E为氢元素.
(1)由上述分析可知,A为Na元素;B为O元素;C为S元素.
故答案为:Na;O;S.
(2)D为氮元素,单质中氮原子之间形成3对共用电子对,结构式为N≡N.
故答案为:N≡N.
(3)E2B2 为H2O2,氢原子与氧原子之间形成1对共用电子对,氧原子与氧原子之间形成1对共用电子对,电子式为
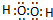
;D、E形成的化合物为NH3,氮原子与氢原子之间形成1对共用电子对,电子式为
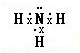
;
A、B、E形成的化合物为NaOH,属于离子化合物,由钠离子与氢氧根离子构成,电子式为
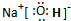
.
故答案为:
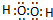
;
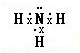
;
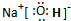
.
(4)A为Na元素,B为O元素A、B两元素组成的化合物A2B2为Na2O2,属于离子化合物,由钠离子与过氧根离子构成,钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间形成1对共用电子对,为共价键.
故答案为:离子;离子键、共价键.
本题解析:
本题难度:一般
2、选择题 短周期元素甲、乙、丙,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素的最高正价和最低负价的代数和等于4.则下列判断不正确的是( )
A.丙元素的族序数比甲元素的大
B.原子半径从大到小的顺序:甲>乙
C.甲的最高价氧化物的水化物的酸性比硝酸的强
D.乙、丙元素的气态氢化物的热稳定性:乙>丙
参考答案:C
本题解析:
本题难度:一般
3、选择题 X、Y、Z都是短周期元素,X原子的最外层只有1个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有2种正价,两种正价的差值为2。由X、Y、Z三种元素组成的化合物的化学式可能是
[?]
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4
A.①②③?
B.④⑤⑥
C.②⑤⑥?
D.①③⑤
参考答案:C
本题解析:
本题难度:简单
4、选择题 元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构.以下关于A、B元素性质的比较中,正确的是( )
①原子序数:A>B?②离子半径:aAm+<bBn-
③原子半径:A<B?④元素所在的周期数:A>B
⑤A的最高正价与B的最低负价的绝对值相等?⑥b=a+m-n.
A.②③④
B.①②④
C.④⑤⑥
D.②⑤⑥
参考答案:①元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构,则有a-m=b+n,则有a>b,故①正确;
②核外电子排布相同的离子,核电核数越大,离子半径越小,则:离子半径:aAm+<bBn-,故②正确;
③A在B的下一周期,电子层数A>B,电子层数越多,半径越大,则原子半径:A>B,故③错误;
④根据a-m=b+n可知A在B的下一周期,电子层数A>B,故④正确;
⑤能确定原子最外层电子数,无法确定A的最高正价与B的最低负价的绝对值是否相等,故⑤错误;
⑥元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构,则有a-m=b+n,即b=a=m-n,故⑥错误.
正确的有①②④.
故选B.
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是
[? ]
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是先排在能量低的电子层上
C.两种微粒的核外电子排布完全相同,则其化学性质一定相同
D.微粒只有在最外层是8个电子时,才最稳定
参考答案:B
本题解析:
本题难度:简单