1、选择题 下列有关电解质溶液的说法正确的是?
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.CH3COOH溶液加水稀释后,溶液中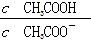 的值减小
的值减小
C.Na2CO3溶液中加入少量Ca(OH)2固体,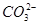 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
参考答案:B
本题解析:A项,蒸馏水中滴加浓H2SO4,温度升高,Kw增大;B项,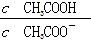 分子分母同乘以溶液中的c(H+),变形后为
分子分母同乘以溶液中的c(H+),变形后为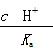 ,稀释醋酸时c(H+)变小,因而比值变小;C项,
,稀释醋酸时c(H+)变小,因而比值变小;C项,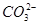 +Ca(OH)2(s)=CaCO3(s)+2OH-,溶液中c(OH-)增大,
+Ca(OH)2(s)=CaCO3(s)+2OH-,溶液中c(OH-)增大,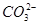 的水解程度减小,但溶液的碱性增强,pH增大;D项,NaCl溶于水电离不水解,CH3COONH4促进水解。
的水解程度减小,但溶液的碱性增强,pH增大;D项,NaCl溶于水电离不水解,CH3COONH4促进水解。
本题难度:一般
2、填空题 水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O? b. CH3COONa? c. NH4Cl? d. NaHSO4
常温下呈酸性的溶液有?(填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: ??、
??,该溶液中的离子浓度由大到小的顺序是:??。
(3)有浓度均为0.1 mol?L-1的 ①盐酸②硫酸③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为?;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为?;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为?。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的表达式:?,现将足量AgCl固体投入100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)=?mol/L(忽略溶液体积的变化)。
参考答案:(18分)(每空各2分)(1)c.d?(2)HCO3- H++CO32-?HCO3-+H2O
H++CO32-?HCO3-+H2O H2CO3 +OH—?c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)
H2CO3 +OH—?c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)
(3)②>①>③?①=③>②?①=②>③
(4)AgCl(S)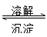 ?Ag+(aq)+Cl-(aq)?9×10-10
?Ag+(aq)+Cl-(aq)?9×10-10
本题解析:(1)氨水是弱碱,溶液显碱性。醋酸钠溶于水,CH3COO-发生水解,溶液显碱性。氯化铵溶于水,NH4+发生水解,溶液显酸性。硫酸氢钠盐,溶于水,完全电离出氢离子,溶液显酸性,答案选cd。
(2)碳酸氢钠是弱酸的酸式盐,既有HCO3-的水解平衡,也有HCO3-的电离平衡,有关的离子方程式是HCO3- H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O H2CO3 +OH—。由于水解程度,大于电离程度,所以溶液显碱性,有关离子浓度的大小关系是c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)。
H2CO3 +OH—。由于水解程度,大于电离程度,所以溶液显碱性,有关离子浓度的大小关系是c(Na+)>c(HCO32—)> c(OH—) > c(H+) > c(CO32-)。
(3)盐酸是一元缺少,硫酸是二元强酸,醋酸是一元弱酸,所以在物质的量浓度相等的条件下,三种溶液的c(H+)大小顺序为②>①>③;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次的大小关系为①=③>②;在稀释过程中,醋酸内继续电离出氢离子,所以稀释后三种溶液的pH的大小关系为①=②>③。
(4)AgCl溶解平衡的表达式为AgCl(S) ?Ag+(aq)+Cl-(aq)。溶液中氯离子的浓度是0.2mol/L,则根据氯化银的溶度积常数可知,溶液中c(Ag+)=
?Ag+(aq)+Cl-(aq)。溶液中氯离子的浓度是0.2mol/L,则根据氯化银的溶度积常数可知,溶液中c(Ag+)=
点评:该题是中等难度的试题,试题注重基础性知识的检查和巩固。该题考查的知识点比较分散,主要是围绕弱电解质的电离平衡和溶解平衡展开的,有利于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、归纳、总结问题的能力。
本题难度:困难
3、选择题 在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
参考答案:A.NH4+与OH-反应而不能大量共存,故A错误;
B.在碱性条件下,离子之间不发生任何反应,可大量共存,故B正确;
C.Mg2+与OH-反应,Ca2+、HCO3-与OH-反应生成沉淀而不能大量共存,故C错误;
D.SO32-具有还原性,可与Na2O2发生氧化还原反应,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 常温下测得某溶液中由水电离出的c(H+)水=1×10-13mol·L-1,那么该溶液中还一定存在的离子是
A.AlO—2、ClO-、Na+
B.Mg2+、SO2-4、Cl-
C.Fe2+、Cu2+、NO—3
D.Ba2+、K+、NO—3
参考答案:D
本题解析:常温下测得某溶液中由水电离出的c(H+)水=1×10-13mol·L-1,即该溶液为抑制水的电离,则该溶液可能是酸性溶液,也可能是碱性溶液。
A选项中,AlO—2、ClO-在酸性溶液中不能大量共存;B选项中Mg2+在碱性溶液中不能大量共存;C选项中,Fe2+、Cu2+在碱性溶液中不能大量共存,且Fe2+、NO—3在酸性溶液中会发生氧化还原反应,也不能大量共存。
本题难度:一般
5、选择题 常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol?L-1的溶液中:K+、ClO-、SO42-、SCN-
参考答案:A、因PH=1的溶液有大量H+,则H+、Fe2+、NO3-发生氧化还原反应,则不能大量共存,故A错误;
B、因水电离的c(H+)=1×10-14mol?L-1<1×10-7mol?L-1,抑制了水的电离,则溶液可能为酸或碱的溶液,HCO3-既与H+反应又能与OH-反应,则一定不能大量共存,故B错误;
C、由c(H+)/c(OH-)=1012的溶液,则c(H+)Kwc(H+)=1012,即c(H+)=1×10-1mol?L-1,在酸性条件下该组离子不反应,则能大量共存,故C正确;
D、因Fe3+与SCN-结合生成络离子Fe(SCN)2+,则不能大量共存,故D错误;
故选:C.
本题解析:
本题难度:一般