1、选择题 下列化学用语使用不正确的是
A.Na+的结构示意图为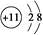
B.明矾的化学式为KAl(SO4)2·12H2O
C.聚乙烯的结构简式为CH2==CH2
D.高氯酸(HClO4)中氯元素的化合价为+7
参考答案:C
本题解析:聚乙烯为聚合物,结构简式不是CH2==CH2,故C项错。
本题难度:一般
2、选择题 在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关SO2-2e-+2H2O→SO42-+4H+反应的说法错误的是
A .该反应为氧化反应?
.该反应为氧化反应?
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行?
D.通入Cl2会降低SO2的漂白作 用
用
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (6分)铁丝在氯气中点燃发生反应:2Fe + 3Cl2  2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。
2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。
参考答案:(6分)(每空1分)
降低, 还原, 还原 , 还原。1 ,3 。
本题解析:根据2Fe + 3Cl2  2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。
2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。
考点:考查氧化还原反应的分析,还原剂、氧化剂的判断,转移电子数的判断
本题难度:一般
4、选择题 同温同压下,若2体积单质气体A2和1体积单质气体B2化合生成2体积气体C,则C的化学式为(?)
A.A2B2
B.AB
C.AB2
D.A2B
参考答案:D
本题解析:根据阿伏加德罗定律和质量守恒定律可知,C的化学式是A2B,答案选D。
本题难度:一般
5、选择题 判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:是否有电子转移
B.共价化合物:是否含有共价键
C.强弱电解质:电解质溶解度大小
D.金属晶体:晶体是否能够导电
参考答案:A
本题解析:氧化还原反应的特征是化合价的升降,实质是电子的转,A正确。含有共价键的不一定是共价化合物,全部由共价键形成的化合物才是共价化合物,B不正确。强弱电解质的区分在于是否完全电离,与溶解度无关,C不正确。由金属键形成的晶体是金属晶体,能导电的晶体不一定是金属晶体,D不正确。答案选A。
本题难度:简单