1、填空题 
参考答案:

本题解析:略
本题难度:一般
2、简答题 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl2的物质的量浓度.
参考答案:(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:23.2g×75%87g/mol=0.2mol,则:
MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
1? 1
0.2mol? n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.2mol×4=0.8mol,故参加反应的浓盐酸的体积为0.8mol10mol/L=0.08L,
答:参加反应的浓盐酸的体积是0.08L;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为0.2mol0.2L=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.
本题解析:
本题难度:一般
3、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是:(? )
A.CCl4的电子式:
B.水分子的结构式:H—O—H
C.NH4Cl的电子式:
D.质量数为37的氯原子: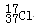
参考答案:B
本题解析:A中要注意氯原子也应该写出电子,B中结构式是正确的,单线代表一对共用电子对,C还是氯离子电子式未表示,D? 17与37的位置应该互换。
本题难度:一般
4、选择题 不属于氧化还原反应的是
A.2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
B.2Mg+CO2 2MgO+C
2MgO+C
C.N2+3H2 2NH3
2NH3
D.SiO2+CaO CaSiO3
CaSiO3
参考答案:D
本题解析:略
本题难度:简单
5、选择题 在给定条件下,下列划线的物质在化学反应中能被完全消耗的是( )
A.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
B.标准状况下,将1g铝片投入20mL18mol?L-1的硫酸中
C.常温下,向100mL3mol?L-1的硝酸中加入6.4gCu
D.将含有少量H2O(g)的H2通入足量Na2O2容器中并不断用电火花点燃
参考答案:A、二氧化硫和氧气反应生成三氧化硫的反应是可逆反应,存在反应限度,不能完全反应,故A错误.
B、18mol/L的浓硫酸在标况下能与Al发生钝化,生成的致密氧化物薄膜阻止反应的进一下发生,则Al不会被完全反应掉,故B错误.
C、n(Cu)=6.4g64g/mol=0.1mol,n(HNO3)=0.1mL×3mol?L-1=0.3mol,根据方程式3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,0.1molCu完全反应需硝酸0.8mol,所以Cu有剩余,故C错误.
D、由于电火花的引燃,氢气与生成的氧气反应生成水,水再与过氧化钠反应生成氧气,如此循环反应,相当于H2与Na2O2反应生成NaOH,过氧化钠足量,所以氢气完全反应,故D正确.
故选:D.
本题解析:
本题难度:一般