1、填空题 已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式: 。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是 。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为 mol。
参考答案:(1)5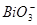 +2Mn2++14H+=5Bi3++2
+2Mn2++14H+=5Bi3++2 +7H2O
+7H2O
(2)PbO2>KMnO4>H2O2
(3)紫红色褪去,生成(白色)沉淀
(4)0.006
本题解析:根据实验①中的现象,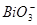 把Mn(NO3)2氧化成
把Mn(NO3)2氧化成 ,本身被还原成Bi3+,离子方程式:5
,本身被还原成Bi3+,离子方程式:5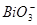 +2Mn2++14H+=5Bi3++2
+2Mn2++14H+=5Bi3++2 +7H2O。根据实验②和③,H2O2能还原
+7H2O。根据实验②和③,H2O2能还原 ,而PbO2又把
,而PbO2又把 的还原产物氧化成
的还原产物氧化成 ,所以氧化性PbO2>KMnO4>H2O2;向含有
,所以氧化性PbO2>KMnO4>H2O2;向含有 的溶液中通入SO2气体,由于SO2还原性较强,所以紫红色褪去,生成PbSO4白色沉淀。根据电子守恒得:
的溶液中通入SO2气体,由于SO2还原性较强,所以紫红色褪去,生成PbSO4白色沉淀。根据电子守恒得:
2 ~ 5O2
~ 5O2
0.006 mol 0.015 mol
所以根据锰元素守恒,反应①中被氧化的Mn(NO3)2为0.006 mol。
本题难度:一般
2、选择题 下列叙述中能肯定A金属比B金属金属性强的是? (? )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
参考答案:D
本题解析:A.比较元素金属性的强弱不能通过看原子最外层电子数的多少。错误。B. 比较元素金属性的强弱不能通过看原子核外电子层数的多少。错误。C.比较元素金属性的强弱不能也不能看金属与酸反应置换H2的多少。错误。D.金属活动性的强弱可以通过金属与水或酸置换出氢气的难易。活动性强的能够把水中是氢置换出来,活动性弱的不能把水中的氢置换出来。正确。
本题难度:一般
3、选择题 已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol?
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系

C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
参考答案:解;A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、图象中的焓变应是2molCO燃烧的反应热,图象中物质的量和焓变不统一,故B错误;
C、热化学方程式同乘以2,焓变也乘以2,热化学方程式为2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H=-452kJ/mol,故C错误;
D、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol?②Na2O2(s)+CO2(g)=Na2CO3(s)+12O2(g);△H=-226kJ/mol,根据盖斯定律合并热化学方程式得到,②×2+①得到的热化学方程式为?2CO(g)+2Na2O2(s)=2 Na2CO3(s);△H=-1018kJ/mol; CO(g)与Na2O2(s)反应放出509kJ热量时,热化学方程式为CO(g)+Na2O2(s)=2Na2CO3(s);△H=-509kJ/mol;反应的电子转移数为2mol即电子转移数为1.204×1024,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 已知Br2+2Fe2+=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2,Cl2+2Br-=2Cl-+Br2请判断I2、Br2、Cl2、Fe3+?的氧化性由强到弱的顺序是( )
A.I2>Br2>Cl2>Fe3+
B.Cl2>Br2>I2>Fe3+
C.Fe3+>I2>Br2>Cl2
D.Cl2>Br2>Fe3+>I2
参考答案:反应Br2+2Fe2+=2Fe3++2Br-中,氧化剂是Br2,氧化产物是Fe3+,所以氧化性:Br2>Fe3+,
反应2Fe3++2I-=2Fe2++I2中,氧化剂是Fe3+,氧化产物是I2,所以氧化性:Fe3+>I2,
反应Cl2+2Br-=2Cl-+Br2中,氧化剂是Cl2,氧化产物是Br2,所以氧化性:Cl2>Br2,
综上,氧化性顺序为Cl2>Br2>Fe3+>I2.
故选D.
本题解析:
本题难度:简单
5、选择题 已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是(? )
A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+
B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+2H++SO42-=SO2+O2+2H2O
D.2Fe3++2I-=2Fe2++I2
参考答案:C
本题解析:略
本题难度:简单