1、实验题 为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
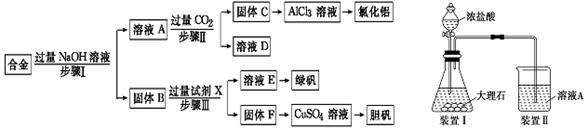
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是?,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有?。
(2)溶液A中的离子主要有Na+、OH-、?;试剂X是?。
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,
观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示)?;为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和?溶液的洗气瓶。
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)?、冷却结晶、过滤洗涤。
参考答案:(1)过滤?漏斗?(2)AlO2-?稀硫酸
(3)Al(OH)3+3H+=Al3++3H2O? NaHCO3?(4)蒸发、浓缩
本题解析:(1)根据流程图可知,步骤Ⅰ、Ⅱ、Ⅲ中均得到滤液和固体,这说明都需进行的实验操作是过滤。在过滤操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器是漏斗。
(2)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠和过量的氢氧化钠,因此含有的离子是Na+、OH-、AlO2-;铜不能和稀硫酸反应,铁可以和硫酸反应,所以滤液F是硫酸亚铁和稀硫酸的混合液,滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为Cu+H2SO4+3H2O+H2O2=CuSO4?5H2O。
(3)应用浓盐酸易挥发,所以生成的CO2气体中含有氯化氢气体,氢氧化铝可以溶解在盐酸中,因此固体C逐渐减少,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;为了避免固体C减少,就必须除去CO2气体中混有的氯化氢气体,所以改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶。
(4)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾。
本题难度:一般
2、简答题 铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:
①4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O32NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)固体X中主要含有______(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用______(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是______.
物质溶解度/(g/100g水)0°C40°C80°CKCl2840.151.3NaCl35.736.438K2Cr2O74.726.373Na2Cr2O7163215376
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、过滤、______、干燥.
(4)表格是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______. | 物质 | 溶解度/(g/100g水)
0°C
40°C
80°C
KCl
28
40.1
51.3
NaCl
35.7
36.4
38
K2Cr2O7
4.7
26.3
73
Na2Cr2O7
163
215
376
|
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n?g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m?g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如下:
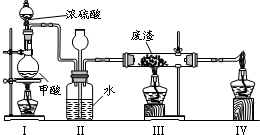
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是______.
参考答案:(1)铬铁矿的主要成分可表示为FeO?Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氧气和碳酸钠,发生反应为:
①4FeO?Cr2O3+8Na2CO3+7O2750℃
本题解析:
本题难度:一般
3、选择题 下列除杂质选用试剂和主要操作都正确的是
?
| 物质
| 杂质
| 试剂
| 主要操作
|
A
| SiO2
| Fe2O3
| 盐酸
| 过滤
|
B
| NaHCO3
| NH4Cl
| —
| 加热
|
C
| 铁粉
| 铜粉
| 稀硫酸
| 过滤
|
D
| 甲烷
| 乙烯
| 溴水
| 蒸馏
|
?
参考答案:A
本题解析:A中二氧化硅与盐酸不溶,氧化铁与盐酸溶解,正确。B中加热时都能分解,不能分离,错误;C中铁会和硫酸反应,原料物质受到破坏,错误;D甲烷是气体,不需要蒸馏。
本题难度:一般
4、选择题 下列实验操作有错误的是( )
A.用CCl4萃取溴水中的溴分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
C.用焰色反应检验Na+时,用玻璃棒蘸取试样置于火焰上灼烧观察火焰颜色
D.蒸发结晶时,当加热到有大量固体出现时停止加热,用余热蒸干
参考答案:A.为防止液体重新污染,分液时分液漏斗下层液体从下口放出,上层液体从上口倒出,故A正确;
B.为充分冷凝,使水充满冷凝管,应从冷凝管的下口通入,上口流出,故B正确;
C.玻璃中含有Na元素,影响实验结果,应用铂丝或铁丝,故C错误;
D.蒸发不能直接蒸干,防止温度过高而导致固体分解,应当加热到有大量固体出现时停止加热,用余热蒸干,故D正确.
故选C.
本题解析:
本题难度:简单
5、选择题 现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
[? ]
A.分液、萃取、蒸馏
B.萃取、分液、蒸馏
C.萃取、蒸馏、分液
D.分液、蒸馏、萃取
参考答案:D
本题解析:
本题难度:简单