1、选择题 从海水中提取下列物质,可以不涉及化学变化的是
A.Mg
B.K
C.NaCl
D.Br2
2、填空题 以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。

已知以下四种物质的溶解度曲线图:
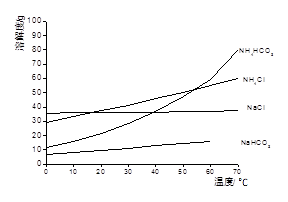
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 ?、?。
(2)“滤渣1”的化学式为?。
(3)在“滤液1”中加入盐酸的目的是?。“滤渣2”的化学式为?。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为?。
物质
| 电离常数(25℃)
|
H2CO3
| K1=4.4X10-7?K2=4.7X10-11
|
H2SO3
| K1=1.23X10-2?K2=5.6X10-8
|
?
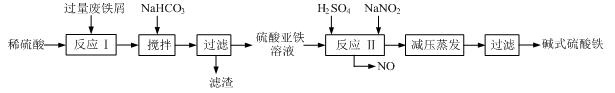
3、填空题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
?
回答下列问题:
(1)加入过量废铁屑的目的是?,此时溶液中存在的阳离子主要有?,用NaHCO3调整溶液pH时的离子方程式是?。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是?。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式?。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产?吨碱式硫酸铁。
4、计算题 (10分)1 mol某直链烷烃A,可以直接裂解成1mol气态烷烃B和1mol气态烯烃C。已知此裂解气的平均相对分子质量与空气的平均相对分子质量相同。请完成下列问题:
(1)A可能是____________;C可能是____________。
(2)若将1体积B完全燃烧,需2体积O2(气体体积在同温同压下测定),则C应是____________。该烯烃发生加聚反应的化学方程式为___________________________。
5、实验题 二氧化铈 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含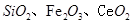 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
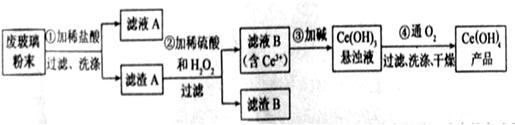
(1)洗涤滤渣A的目的是为了去除?(填离子符号),检验该离子是否洗净的方法是?。
(2)第②步反应的离子方程式是?,滤渣B的主要成分是?。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP?(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有?、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
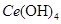 产品0.536g,加硫酸溶解后,用0.1000mol?
产品0.536g,加硫酸溶解后,用0.1000mol?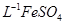 溶液(铈被还原为
溶液(铈被还原为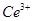 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中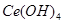 的质量分数为?。
的质量分数为?。