1、选择题 气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法正确的是 (? )
A.元素的第一电离能越大,其金属性越强
B.元素的第一电离能越小,其金属性越强
C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
D.同周期元素,第一电离能随原子序数增大逐渐增大
参考答案:B
本题解析:第一电离能越小,说明金属越易失电子,其金属性越强,但与酸反应却未必越易。
本题难度:一般
2、选择题 不能作为元素周期表中元素排列顺序的依据的是?(?)
A.原子的核电荷数
B.原子的核外电子数
C.原子的质子数
D.原子的中子数
参考答案:D
本题解析:略
本题难度:简单
3、填空题 元素A、B是周期表中处在同一主族,相邻周期的两种元素,A的原子序数为m,A、B所在周期包含的元素种类分别为x、y。
(1)如果A和B同在ⅡA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________;
(2)如果A和B同在ⅥA,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________。
参考答案:m-y; m+x; m-x; m+y
本题解析:(1)如果A和B同在ⅡA,当B在A的上一周期时,B的原子序数为m-y;当B在A的下一周期时,B的原子序数为m+x。
(2)如果A和B同在ⅥA,当B在A的上一周期时,B的原子序数为m-x;当B在A的下一周期时,B的原子序数为m+y。
点评:考查元素周期表的基本结构,属于基础题。解题的关键在于掌握周期表中,相邻周期的元素个数差。
本题难度:一般
4、选择题 19世纪中叶,俄国化学家门捷列夫的突出贡献是?(?)
A.提出原子学说
B.提出分子学说
C.发现元素周期律
D.发现氧气
参考答案:C
本题解析:19世纪中叶,俄国化学家门捷列夫的突出贡献是发现元素周期律。提出原子学说的是道尔顿,提
出分子学说的是阿伏加德罗,答案选C。
点评:该题是基础性试题的考查,难度不大,记住即可。有利于调动学生的学习兴趣和学习化学的积极性。
本题难度:简单
5、填空题 (16分)Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。

(1)写出W的简单离子的原子结构示意图?;
氢元素与Z形成原子个数比为1∶1的化合物,其结构式为??。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)?;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
? ?,
?,
反应中每转移8mol 电子,消耗的还原剂质量为?g。
(4)写出能说明Y的非金属性比Z弱的一个实验事实:?
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:
CO+ H2O(g) 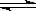 CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为?。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为?。
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该氢氧燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2 = 2CO2+ 4H2O,则其正极的电极反应式??
参考答案:Ⅰ(1)硫离子的结构示意图(略);H-O-O-H
(2 )NH4+ +H2O
)NH4+ +H2O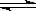 NH3·H2O + H+[来源:学,科,网]
NH3·H2O + H+[来源:学,科,网]
(3)C + 4HNO3 CO2↑ +4NO2↑ +2H2O,24g
CO2↑ +4NO2↑ +2H2O,24g
(4)O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案也可以)
Ⅱ? 83.3%
Ⅲ? O2 + 4H+ +4e- =2H2O
本题解析:略
本题难度:一般