1、填空题 Al和Si、Ge(锗)和As(砷)在元素周期表金属和非金属过渡位置上,且砷(As)与氮同主族,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)As的价电子排布式为____________。
(2)AlCl3是化工生产中的常用催化剂,熔点为192.6℃,熔融状态以二聚体Al2Cl6形式存在,Al2Cl6中化学键类型是____________。
(3)超高导热绝缘耐高温纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与____个N原子相连,与同一个Al原子相连的N原子构成的空间构型为_________。在四大晶体类型中,
AlN属于____晶体。
(4)Si和C同主族,Si、C和O成键情况如下

在SiO2中,硅原子轨道杂化形式为________,1mol CO2中含有π键数目为______________。二氧化碳的熔沸点远低于二氧化硅的原因是____________。
(5)SiCl4(液)常用作烟雾剂,原因Si存在3d轨道,能同H2O(液)配位而剧烈水解,在潮湿的空气中发烟,试用化学方程式表示其原理_____________________。
2、选择题 下列关于微粒结构的描述正确的是( )
A.CS2为V形的极性分子
B.ClO3-?的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO32-?的中心原子均为sp3杂化
3、选择题 下列有关杂化轨道的说法中不正确的是
[? ]
A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不相等
C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理
D.杂化轨道可分为等性杂化轨道和不等性杂化轨道
4、选择题 下列表达式错误的是
[? ]
A.甲烷的电子式: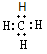 ?
?
B.氮原子的L层电子的电子排布图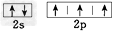 ?
?
C.硫离子的核外电子排布式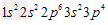 ?
?
D.碳-12原子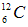 ?
?
5、填空题 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式_________________;CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为?____________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是__________;分子中处于同一直线上的原子数目最多为_________。
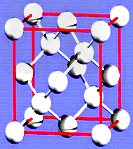
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3,?表示阿伏加德罗常数,则立方氮化硼晶胞体积为_______cm3。