| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《水的电离平衡》练习题(十)
参考答案:D 本题解析:A、金属铝能和酸反应也能和碱反应生成氢气,所以不选A;B、加入酚酞后显无色的溶液也可能是中性的或弱碱性的,所以不选B;C、没有说明溶液的温度,不能确定溶液中氢离子和氢氧根离子浓度之间的关系,不选C;D、当氢离子浓度大于氢氧根离子浓度时,溶液显酸性,选D。 本题难度:一般 2、选择题 以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示。横轴为加入氢氧化钠的体积数,纵轴为溶液的pH。下列正确的是 |
参考答案:A
本题解析:由图象可知,起始酸的pH为4,故c(H+)=10-4mol/L,故酸的浓度必大于10-4mol/L,B项错误;此滴定终点为pH=10,溶液显碱性而甲基红变色范围4.2~6.3,显酸性,故应选择酚酞作指示剂,故C项错误;酸碱中和反应为发热反应,故D项错误;设一元酸为HA,由图可知当加入NaOH溶液5ml时溶液溶质恰好为HA、NaA物质的量之比1:1的混合物,故Ka=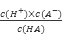
 1.0×10-6,故A项正确;本题选A。
1.0×10-6,故A项正确;本题选A。
考点:酸碱中和滴定。
本题难度:一般
3、选择题 下列操作中,能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入NaOH溶液
D.将水加热到100℃,使pH=6
参考答案:A、硫酸氢钠的电离:NaHSO4=Na++H++SO42-,硫酸氢钠溶液相当于稀硫酸,对水的电离起抑制作用,故A错误;
B、向水中加入硫酸铝溶液,铝离子水解促进水的电离,铝离子和氢氧根离子生成氢氧化铝,使溶液中氢离子浓度大于氢氧根离子浓度,所以溶液呈酸性,故B正确;
C、向水中加入氢氧化钠溶液,氢氧根离子抑制水的电离,溶液中氢氧根离子浓度大于氢离子浓度,所以溶液呈碱性,故C错误;
D、水的电离是吸热反应,升高温度能促进水的电离,使平衡向正反应方向移动,但溶液中氢离子浓度和氢氧根离子浓度仍然相等,溶液呈中性,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 常温下,测得柠檬水溶液的pH是3,其中的c(OH-)是( )mol/L:
A.1x10-3
B.0.1
C.1x10-7
D.1x10-11
参考答案:D
本题解析:考查pH和水的离子积的有关计算。氢离子浓度的负对数称为pH,pH=3,则c(H+)=0.001mol·L-1,由水的离子积常数可得出c(OH-)=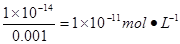 ,故答案选D。
,故答案选D。
本题难度:一般
5、选择题 下列说法正确的是:
A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1
B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-)
D.硫化钠溶液中,C (Na+) =" 2" C (S2-)
参考答案:C
本题解析:氨水中存在电离平衡,稀释促进电离,所以相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是小于2∶1,A不正确;氯化铵是强酸弱碱盐,NH4+水解,因此1mol/L NH4Cl溶液中 C(NH4+)< C(Cl-),B不正确;C中根据电荷守恒可知,C (Na+)+C(H+)=C(OH-)+C (CH3COO-),溶液显中性,则C(H+)=C(OH-),所以C (Na+) =" C" (CH3COO-),选项C正确;硫化钠溶于水,S2-水解,则根据物料守恒可知,C (Na+)=2 C (S2-)+2 C (HS-)+2 C (H2S),选项D不赀之器,答案选C。
考点:考查弱电解质的电离、盐类水解以及离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确有关原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合题意灵活运用即可。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《金属及其化.. | |