1、选择题 研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
[? ]
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
参考答案:C
本题解析:
本题难度:简单
2、实验题 (15分)
某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应.其中D为纯净干燥的氯气与纯净干燥氨气反应的装置.
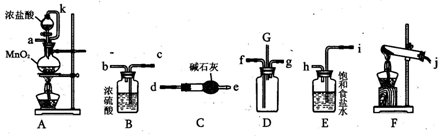
请回答下列问题:
(1)连接好装置后,必需进行的一步实验操作是?。
(2)装置E的作用是?,橡胶管k的作用是?。
(3)从装置D的G处逸出的尾气中可能含有黄绿色的有毒气体,处理方法是?。
(4)装置F中试管内发生反应的化学方程式____?。
(5)接入D装置的两根导管左边较长、右边较短,目的是______?.
(6)整套装置从左向右的连接顺序是(j)接(?)(?)接(f)(g)接(?)(?)接(?)(?)接(a).
参考答案:(15分)
(1)检查装置的气密性(1分)
(2)除去氯气中的氯化氢(2分)使分液漏斗中的盐酸顺利流下(2分)
(3)在G连接导管直接通入盛有烧碱的烧杯中(2分)
(4)2NH4Cl+Ca(OH)2?△?CaCl2+2H2O+2NH3↑(3分)?
(5)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(6)(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)(3分,全对才得分)
本题解析:(1)连接好装置后,需进行装置气密性的检查;
(2)D为纯净干燥的氯气与纯净干燥氨气反应的装置,所以反应前应先除杂、干燥,因此装置E的作用是除去氯气中的氯化氢气体,橡胶管k与分液漏斗的上口相连,达到连通器的效果,方便浓盐酸顺利滴下;
(3)从G处逸出黄绿色气体氯气,氯气有毒,直接排放会污染空气,所以应在G处接一导气管通入氢氧化钠溶液中;
(4)F为实验室制取氨气的装置,所以F中发生的化学方程式为
2NH4Cl+Ca(OH)2△? CaCl2+2H2O+2NH3↑
(5)因为氯气浓度较大,氨气密度较小,所以左边应通入氨气,右边通入氯气使二者混合均匀;
(6)整套装置从左向右的连接顺序是(j)….,说明装置左边是生成氨气的装置,经过碱石灰干燥通入D的f口中,产生的氯气经过饱和食盐水除杂、浓硫酸干燥,通入D的g口中,所以装置的连接顺序是(j)接(d)(e)接(f)(g)接(b)(c)接(h)(i)接(a)。
本题难度:一般
3、选择题 配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是
A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度
C.定容时俯视刻度线
D.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理
参考答案:C
本题解析:应逐个分析每个选项,找出正确的选项:因为cB=nB/V,若错误操作使nB增大,V减小,则cB偏大,若错误操作使nB减小,V增大,则cB偏小.A操作使nB减少,B操作使V增大,C操作使V减小,D操作对nB和V均无影响,故A、B操作使cB减小,C操作使cB增大,D无影响.
本题难度:简单
4、实验题 文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究:
(1) 提出合理的假设:该酸雨中的溶质除H2SO4、HCl外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有?。
(2) 设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
实验步骤
| 预期现象和结论
|
步骤1:取适量酸雨于A、B两支洁净试管中,待用。
| ?
|
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤。
| ?
|
步骤3:取少量步骤2得到的滤渣加入足量的盐酸。
| ?
|
步骤4:取少量步骤2得到的的滤液,加入?
?。
| ?
?
|
步骤5:往B试管中加入?
?。
| ?
?
参考答案:(12分)(1)SO2(或H2SO3)(2分)
(2)每空2分
实验步骤
预期现象和结论
步骤3:
若滤渣不完全溶解则酸雨中含有硫酸
步骤4:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液
若产生白色沉淀,则酸雨中含有盐酸
步骤5:往B试管中加入几滴品红溶液,振荡
若品红溶液褪色,则所以中含有亚硫酸或SO2
本题解析:(1)由于酸雨中硫酸是亚硫酸被氧化后生成的,所以 主要溶质还一定有亚硫酸或SO2。
(2)由于硫酸钡和亚硫酸钡都是不溶于水的白色沉淀,但硫酸钡还不能溶于酸中,所以步骤3中,预期的现象和结论应该是:若滤渣不完全溶解则酸雨中含有硫酸;氯离子的检验一般用硝酸酸化的硝酸银溶液,所以步骤4应该是:取少量步骤2得到的的滤液,加入过量的硝酸银,然后加入少量的硝酸银溶液。预期的现象和结论应该是:若产生白色沉淀,则酸雨中含有盐酸。SO2的检验一般用品红溶液,所以步骤5应该是:往B试管中加入几滴品红溶液,振荡。预期的现象和结论应该是:若品红溶液褪色,则所以中含有亚硫酸或SO2。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,侧重对学生基础性知识的巩固与训练,有助于培养学生综合实验能力和规范严谨的实验实际能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、实验题 用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1) 用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl溶液的pH ?7(填“<”、“=”或“>”),显?性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为?;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为?。
(3) 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)?。
A.氨水与氯化铵发生化学反应? B.氯化铵溶液水解显酸性,增大了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
参考答案:(1)<?酸? NH4++H2O NH3·H2O+H+ NH3·H2O+H+
(1)H2?(3)C
本题解析:(1)NH4Cl是强酸弱碱盐,NH4+水解显酸性,方程式为NH4++H2O NH3·H2O+H+。 NH3·H2O+H+。
(2)氯化铵显酸性,所以能和镁反应产生氢气。
(3)氨水中存在电离平衡NH3·H2O NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。 NH4++OH-。加入少量氯化铵固体,增大NH4+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
本题难度:一般
|