1、填空题 (1)用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为:
______?______________
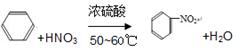
(2)写出苯发生硝化反应的化学方程式:
___________________________________________________________________
参考答案:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)
本题解析:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)
本题难度:一般
2、简答题 在加热条件下,用MnO2与足量浓盐酸反应,制得氯气5.6L(标准状况).问:
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)转移的电子数是多少?
参考答案:(1)标准状况下5.6L氯气的物质的量为5.6L22.4L/mol=0.25mol,则:
由MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
? 1? 1
?0.25mol? 0.25mol
n(MnO2)=n(Cl2)=0.25mol,则m(MnO2)=0.25mol×87g.mol-1=21.75g,
答:需要消耗MnO221.75g;
(2)因Cl元素的化合价升高时被氧化,氧化产物为氯气,
则被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.25mol=0.5mol,
答:被氧化的HCl的物质的量是0.5mol;
(3)反应中氯元素化合价由-1价升高为0价,生成氯气0.25mol,故转移电子物质的量为0.25mol×2=0.5mol,故转移电子的数目为0.5mol×NAmol-1=0.5NA,
答:转移的电子数是0.5NA.
本题解析:
本题难度:一般
3、选择题 下列有关化学用语,表达正确的是?
A.乙醇的分子式:CH3CH2OH
B.苯分子的比例模型:
C.乙炔的电子式: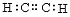
D.溴苯的结构式:C6H5Br
参考答案:B
本题解析:A 错误,这是乙醇的结构简式
B 正确,是比例模型
C 错误,碳的最外层电子没画完。
D 错误,这是溴苯的分子式,结构简式应有苯环。
本题难度:一般
4、填空题 (8分)亚硝酸钠( NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+
NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+ Fe3+
Fe3+
(1)转化1中,氧化剂是??,还原剂是?。
(2)转化2中,Fe3+作?剂,维生素C表现?性。
参考答案:
本题解析:略
本题难度:简单
5、简答题 硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题.
(1)ag铜与bmL浓HNO3充分反应后得到V1L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子.)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量.
( 2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐.
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度.
参考答案:(1)铜与浓硝酸反应的方程式为:发生的反应有:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,随着反应的进行,硝酸浓度降低,则发生:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,则红棕色气体为NO2和NO的混合物,
①根据N元素守恒,被还原的硝酸即为生成NO2和NO的物质的量,n(NO2)+n(NO)=V122.4mol,
m(N)=V122.4mol×14g/mol=7V111.2g,
答:当反应生成X气体时有7V111.2g氮元素被还原;
②再将此红棕色气体通过水变成V2L无色气体Y,发生反应为:3NO2+H2O=2HNO3+NO,
设混合气体中含有xLNO,yLNO2,
则:
本题解析:
本题难度:一般