1、选择题 同主族元素,其原子结构相同之处是( )
A.最外层电子数
B.核电荷数
C.电子层数
D.核外电子数
参考答案:同主族元素的原子,元素周期表中,原子核外最外层电子数相等,同一主族中,从上到下原子的核电荷数、电子层数和核外电子数逐渐增多,
故选A.
本题解析:
本题难度:一般
2、选择题 科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是1s22s22p63s23p6。下列说法正确的是
[? ]
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子都达8电子稳定结构,化学性质相同
参考答案:C
本题解析:
本题难度:一般
3、简答题 0.15mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生正确成5.04LH2和25.65g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属元素在周期表中的位置?
参考答案:标准状况下生成5.04LH2物质的量为0.225mol,质量为0.45g,需要H2SO40.225mol参与反应,H2SO4质量为22.05g,
则0.15mol金属单质的质量为 25.65g+0.45g-22.05=4.05g(生成物质量等于反应物的质量),所以金属的摩尔质量为4.05g0.15mol=27g/mol,所以金属的相对分子质量为27,金属元素原子的质量数为27,
又因为原子核内的质子数比中子数少一个,所以金属元素原子核内的质子为27-12=13,故该元素为铝,核外电子排布为:
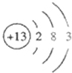
,位于第三周期,第ⅢA族.
故答案为:第三周期,第ⅢA族
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E、F均为短周期元素,原子序数依次增大,A元素原子核内无中子.B元素原子核外最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元素.D是短周期元素中金属性最强的元素.E与D元素的质子数之和为27,最外层电子数之差为5.F元素的最高价氧化物的水化物为强酸.
(1)推断B元素在周期表中的位置:第______周期______族.
(2)写出F元素的电子排布式:______.
(3)C、D元素可形成淡黄色的粉末,其电子式为______,所含化学键为______.
(4)写出A与C元素形成10电子的微粒:______、______、______.
(5)D、E元素形成的正盐的水溶液,阴离子的浓度大小顺序为:(从大到小排列)______.
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量.写出反应的热化学方程式:______.
参考答案:A、B、C、D、E、F均为短周期元素,原子序数依次增大.A元素原子核内无中子,则A为氢元素.B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素.C元素是地壳中含量最多的元素,则C为氧元素.D是短周期元素中金属性最强的元素,则D为钠元素.E与D元素的质子数之和为27,则E元素的质子数为27-11=16,则E为硫元素.F元素的最高价氧化物的水化物为强酸,原子序数比硫大,则F为氯元素.
即A为氢元素、B为碳元素、C为氧元素、D为钠元素、E为硫元素、F为氯元素.
(1)B为碳元素,原子核外有2个电子层,最外层有4个电子,位于周期表第二周期第ⅣA族.
故答案为:二;ⅣA.
(2)F为氯元素,原子核外有17个电子,电子排布式为1s22s22p63s23p5.
故答案为:1s22s22p63s23p5.
(3)C为氧元素、D为钠元素,二者形成的淡黄色物质为Na2O2,Na2O2是离子化合物,由钠离子与过氧根离子构成,
电子式为
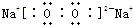
.钠离子与过氧根离子之间形成离子键,过氧根离子中氧原子之间形成1对共用电子对,是非极性共价键.
故答案为:
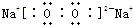
;离子键、非极性共价键.
(4)A为氢元素、C为氧元素,氢元素与氧元素形成10电子的微粒有H2O、H3+O、OH-.
故答案为:H2O、H3+O、OH-.
(5)D为钠元素、E为硫元素,二者形成的正盐为Na2S,属于强碱弱酸盐,所以Na2S的水溶液中,S2-水解S2-+H2O?HS-+OH-,由于水解程度不大,所以离子浓度c(S2-)>c(HS-),由于溶液中存在水的电离,所以c(OH-)>c(HS-),水的电离程度不大,所以c(S2-)>c(HS-),所以阴离子的浓度大小顺序为c(S2-)>c(OH-)>c(HS-).
故答案为:c(S2-)>c(OH-)>c(HS-).
(6)A为氢元素,C为氧元素,常温下,1mol氢气与氧气化合生成液态水,放出286kJ的热量,反应的热化学方程式为H2(g)+12O2(g)=H2O(l);△H=-286kJ/mol.
故答案为:H2(g)+12O2(g)=H2O(l);△H=-286kJ/mol.
本题解析:
本题难度:一般
5、选择题 在两种短周期元素组成的化合物中,若它们的原子个数之比为1:3,设这两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a=b+4?②a+b=8?③a+b=30?④a=b+8?⑤a=b+5.
A.只有②③⑤
B.只有①②③④
C.只有①④⑤
D.①②③④⑤
参考答案:两种元素形成的化合物为AB 3,则A元素化合价为+3,B元素化合价为-1,A在ⅢA族,B在ⅤⅡA族,a与b关系可能是①,如AlF3;③可能,如AlCl3;再考虑符合条件的其他物质,如NH3,②可能;SO3,④可能;C2H6,⑤可能;故选D.
本题解析:
本题难度:一般