1、选择题 氧气和氮气组成的混合气体对氢气的相对密度可能是
A.12.5
B.18.2
C.16.1
D.15.3
参考答案:D
本题解析:所谓相对密度是指:同温、同压下,气体A(可以是单一气体,也可以是混合气体)的密度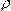 (A)是气体B(可以是单一气体,也可以是混合气体)的密度
(A)是气体B(可以是单一气体,也可以是混合气体)的密度![]() (B)的DB倍,则DB就是气体A对气体B的相对密度,即
(B)的DB倍,则DB就是气体A对气体B的相对密度,即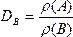 。
。
对于本题,由于不知氧气和氮气是以何种比例混合的,不同的体积比混合可以得出不同的结论,似乎本题无从下手。但是可以分别求出氧气对氢气的相对密度,氮气对氢气的相对密度。依据阿伏加德罗定律,可以推出:同温、同压下,气体的体积之比等于气体的摩尔质量之比,也等于气体的相对分子质量之比,即: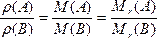 (Mr表示相对原子质量或相对分子质量)。由此得出:
(Mr表示相对原子质量或相对分子质量)。由此得出:
氧气对氢气的相对密度D(H2)=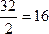
氮气对氢气的相对密度D(H2)=
那么就可以确定:氧气和氮气组成的混合气体对氢气的相对密度一定介于14~16之间。
本题难度:一般
2、选择题 一定量的甲烷与5 mol Cl2充分发生取代反应,结果生成相同物质的量的四种有机物,则参加反应的甲烷的物质的量为
A.1.5 mol
B.2 mol
C.2.5 mol
D.4 mol
参考答案:B
本题解析:
本题难度:一般
3、选择题 烃类分子中碳原子的结合方式是
A.形成2至4个共价键
B.形成非极性键
C.形成四对共用电子对
D.全部形成单键
参考答案:C
本题解析:碳原子的价电子是4个,所以可以形成四对共用电子对,选项C正确,其余是错误的,答案选C。
本题难度:困难
4、选择题 下列气体密度比空气小的是
A.H2
B.O2
C.CO2
D.SO2
参考答案:A
本题解析:分析:相同条件下,密度之比等于相对分子质量之比.据此判断.
解答:相同条件下,密度之比等于相对分子质量之比,所以相对分子质量越大,密度越大.
空气的平均相对分子质量为29.
A、氢气的相对分子质量为2,小于29,所以密度小于空气,故A正确;
B、氧气的相对分子质量为32,大于29,所以密度大于空气的密度,故B错误;
C、二氧化碳的相对分子质量为44,大于29,所以密度大于空气的密度,故C错误;
D、二氧化硫的相对分子质量为80,大于29,所以密度大于空气的密度,故D错误;
故选:A.
点评:考查阿伏伽德罗定律及推论,难度较小,可通过pV=nRT理解阿伏伽德罗定律及推论.
本题难度:简单
5、选择题 将一小块钠放入下列溶液时,既能产生气体又会出现白色浑浊的是
A.稀硫酸
B.氯化铁溶液
C.硫酸铜溶液
D.氯化镁溶液
参考答案:D
本题解析:分析:根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑及生成的碱与盐的反应来得出反应现象.
解答:Na与稀硫酸、稀氯化铁溶液、硫酸铜溶液、氯化镁溶液的反应方程式分别如下:
? 2Na+H2SO4=Na2SO4+H2↑
? 6Na+2FeCl3+6H2O=2Fe(OH)3↓(红褐色)+6NaCl+3H2↑
CuSO4+2Na+2H2O=Cu(OH)2(蓝)↓+Na2SO4+H2↑
MgCl2+2H2O+2Na=Mg(OH)2 (白)↓+2NaCl+H2↑
通过观察,
A.只有气体生成,没有白色沉淀生成,故A错误;
B.氯化铁溶液和钠反应生成红褐色沉淀和气体,故B错误;
C.硫酸铜溶液和钠反应生成蓝色沉淀和气体,故C错误;
D.氯化镁溶液和钠反应生成白色沉淀和气体,故D正确;
故选D.
点评:本题考查的是钠与酸碱盐溶液的反应,表面看钠与碱不反应,无方程式可写,但是钠却能够和溶液中的溶剂水反应所以反应的实质就是钠与水的反应,从另一方面还考查了学生的思维能力.本题的限制条件是:既有气体又有白色沉淀生成,往往会出现漏限制条件的情况,导致答案错误,所以本题属易错题.
本题难度:困难