1、选择题 NO2存在下列平衡:2NO2(g)  N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
A.温度130℃、压强3.03×105 Pa
B.温度25℃、压强1.01×105 Pa
C.温度130℃、压强5.05×104 Pa
D.温度0℃、压强5.05×104 Pa
参考答案:C
本题解析: 测定NO2相对分子质量,应使平衡向逆反应方向移动,所以应选择高温、低压。
本题难度:一般
2、选择题 反应4A(g) + 5B(g) 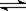 ?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
?4C(g) + 6D(g) △H =-Q kJ/mol,在一定温度下达到化学平衡状态时,下列说法正确的是:
A.若增大压强,A和B的转化率都增大
B.若升高温度最终能生成更多的C和D
C.单位时间里有4n mol A消耗,同时有5n mol B生成
D.容器里A、B、C、D的浓度比是4:5:4:6
参考答案:C
本题解析:该反应是体积增大的放热的可逆反应。增大压强,平衡向逆反应方向移动,A和B的转化率都减小,A不正确。升高温度平衡也向逆反应方向移动,不利于CD的生成,B不正确。平衡后单位时间里有4n mol A消耗,必然同时生成4n mol A,根据速率之比是化学计量数之比,同时也应该生成5n mol B,C正确。达到平衡后容器里A、B、C、D的浓度比不一定是4:5:4:6 ,D不正确。
本题难度:简单
3、填空题 (16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g)?ΔH=-190kJ·mol-1
?2SO3(g)?ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
参考答案:(1) 在450℃时,2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为190 kJ;变小
(2) bd? 4分? (3) 0.036 向正反应方向 0.36 0.40
本题解析:(1)考查热化学方程式的意义。根据反应的热化学方程式可知,在450℃时,2 mol SO2(g)和1 mol O2(g)完全反应生成2 mol SO3(g)时放出的热量为190 kJ。反应是放热反应,升高温度平衡向逆反应方向移动,所以平衡常数变小。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率方向相反,但不满足速率之比是相应但化学计量数之比,不正确。气体的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以bd都可以说明。气体的密度是混合气的质量和容器容积的比值,质量和容积均是不变的,所以密度始终是不变的,c不正确。答案选bd。
(3)容器中含SO3 0.18 mol,则消耗越强就是0.09mol,因此氧气的反应速率是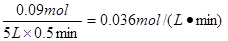 。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
。增大反应物的浓度,平衡向正反应方向移动。所以反应物的转化率增大,因此三氧化硫的物质的量大于0.36mol。由于是可逆反应,转化率不可能是1,所以三氧化硫的物质的量小于0.4mol。
本题难度:一般
4、填空题 (8分)如下图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时A、B的体积均为a L,在相同温度和有催化剂条件下,两容器中各自发生反应:
X(g)+Y(g) ?2Z(g)+W(g)(正反应为放热反应)达到平衡时A容器的体积为1.2a L。
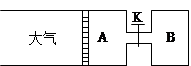
(1)? A中X的转化率αA=??
(2)? A、B中X的转化率αA ??αB(填 >、< 或 = )
(3)?打开K,一段时间又达到平衡时A的体积为?L(连通管中气体体积忽略不计)
(4)?在(3)达到平衡后,同时等幅升高A、B的温度,达到新平衡后,A的体积?(填变大、变小或不变)
参考答案:(1)40%(2)>?(3)2.6a L?(4)变小
本题解析:(1)?X(g)+Y(g) ?2Z(g)+W(g)
起始量(mol)?1? 1? 0? 0
转化量(mol)?x? x? 2x? x
平衡量(mol)?1-x? 1-x? 2x? x
因为体积之比是物质的量之比
所以
解得x=0.4
即转化率是40%
(2)A保持恒压,B保持恒容。正反应是体积增大的反应,压强大转化率低。在反应过程中B中的压强大于A中的。所以A中的转化率大于B中的转化率。
(3)打开之后相当于保持恒压,因此平衡和A是等效的,即转化率是相同的。则平衡时的总体积是1.2aL×3=3.6aL,所以A的体积为3.6aL-aL=2.6aL。
(4)反应是放热反应,升高温度,平衡向逆反应方向移动,体积减小。
本题难度:一般
5、选择题 甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少2molA,则甲容器内的反应速率比乙容器内的反应速率
[? ]
A.快
B.慢
C.相等
D.无法判断
参考答案:D
本题解析:
本题难度:简单