1、选择题 在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量存在的是
[? ]
A.K+
B.Na+
C.Ba2+
D.Al3+
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列各组离子在指定的溶液中不能大量共存的是
A.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42–、Cl–
B.1 mol·L–1的烧碱溶液中:S2–、SO32–、S2–、K+
C.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2–、Cl–
D.含有大量HCO3–的澄清透明溶液中:K+、NH4+、Cl–、Na+
参考答案:C
本题解析:溶液使淀粉碘化钾试纸变蓝说明含有I2,I2能与S2–发生反应:I2 + S2– = 2I– + S,因而不能大量共存,故选C。
本题难度:一般
3、选择题 下列离子在pH=1的无色透明溶液中,不能大量共存的离子组是 ? ? ?
[? ]
A.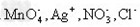
B.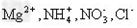
C.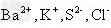
D.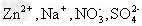
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列离子或分子在pH=0的溶液中能大量共存的是
A.Na+、Cu2+、SO42—、NH3·H2O
B.K+、Al3+、MnO4—、C2H5OH
C.K+、Cl—、NO3—、Fe2+
D.Na+、NH4+、CH3COOH
参考答案:D
本题解析:pH=0的溶液,含大量的H+,溶液离子之间不能结合生成水、气体、沉淀、弱电解质,不能发生氧化还原反应等,则离子大量共存,A、NH3·H2O在酸性溶液中生成NH4+离子,则在溶液中不能共存,故A错误;B、C2H5OH在酸性高锰酸钾溶液中被氧化生成CH3COOH,则在溶液中不能共存,故B错误;C、亚铁离子被硝酸根离子氧化生成铁离子,则在溶液中不能共存,故C错误;D、该组离子之间不反应,能大量共存,故D正确。
本题难度:一般
5、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH,如下表:
实验编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
①
| 0.1
| 0.1
| pH=9
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH<7
|
?
请回答:
(1)从①组情况分析, HA是强酸还是弱酸?。
(2)②组情况表明,c?0.2 (选填“>”、“<”或 “=”)。混合液中离子浓度c(A-) __c(Na+)
(选填“>”、“<”或 “=”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (选填“>”、“<”或 “=”),该混合溶液中离子浓度由大到小的顺序是?。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=??mol·L-1。
写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)=??mol·L-1; c(OH-)-c(HA)=??mol·L-1
参考答案:(1)HA是弱酸;(1分)
(2)? >(1分); c(A-)=c(Na+)(1分)
(3)>(1分); c(A-) >c(Na+) >c(H+)> c(OH-)(1分)
(4)10 -5(1分);? 10 -5-10 -9(2分);10 -9(2分)
本题解析:(l)根据表中数据可知,当二者恰好反应时,溶液显碱性。这说明生成的NaA水解,溶液显碱性,由此可知 HA是弱酸。
(2)HA是弱电解质,如果二者恰好反应,溶液显示碱性。若要使pH=7,则加入的HA应该过量,故应该大c>0.2mol/L。pH=7,氢离子等于氢氧根浓度,根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),由此c(A-)=c(Na+)。
(3)根据③的结果可知,反应后HA是过量的,由此混合液是由等物质的量浓度的HA和NaA组成的。溶液显酸性,说明A-的水解程度小于HA的电离程度,所以溶液中离子浓度大小关系为c(A-) >c(Na+) >c(H+)> c(OH-)。
(4)强碱弱酸盐溶液中,弱酸根结合水电离的氢离子,溶液显示碱性,溶液中的氢氧根就是水电离出来的,所以①组实验所得混合溶液中由水电离出的c(OH-)=10-14÷10-9=10-5mol/L;根据电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),故c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol/L;根据物料守恒可知c(Na+)=c(HA)+c(A-),带人电荷守恒c(Na+)+c(H+)= c(A-)+ c(OH-),得c(OH-)-c(HA)=c(H+)=10-9mol/L。
本题难度:一般