1、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,16?g14CH4中所含的中子数为8?NA
B.标准状况下,22.4?L?CCl4中所含的分子数为NA
C.在1?L?1.0?mol/L?NaCl溶液中含有NA个NaCl分子
D.活泼金属从盐酸中置换出1?mol?H2,转移电子数为2NA
参考答案:D
本题解析:分析:A.根据甲烷的分子数结合一个甲烷分子中含有的中子数计算甲烷中总中子数;
B.标准状况下,CCl4的状态是液体;
C.NaCl电离生成钠离子和氯离子;
D.根据H元素化合价变化分析.
解答:A.18g甲烷的物质的量是1mol,一个甲烷分子中含有8个中子,所以18g14CH4所含的中子的物质的量是8mol,个数为8NA,16?g14CH4的物质的量不是1mol,故A错误;
B.标准状况下,CCl4的状态是液体,22.4?L?CCl4的物质的量不是1mol,故B错误;
C.NaCl电离生成钠离子和氯离子,NaCl溶液中无分子,故C错误;
D.活泼金属从盐酸中置换出1molH2,转移2mol电子,故发生转移的电子数为2NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数,题目难度不大,注意从物质的组成、结构、性质、聚集状态以及存在的条件是否标准状况等角度思考.
本题难度:一般
2、选择题 下列说法正确的是
A.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸等
B.CaCl2、NaOH、HCl、HD四种物质都属于化合物
C.Na2O、Na2O2均属于碱性氧化物
D.有发光、发热、变色、生成气体或沉淀、爆炸等现象的不一定是化学变化
参考答案:D
本题解析:分析:A、根据溶液中电离出的氢离子来分类,有机酸分子中不能依据氢原子数分类;
B、HD是单质;
C、碱性氧化物是和酸反应生成盐和水的氧化物;
D、化学变化的实质是有新物质生成;
解答:A、根据酸能电离出得氢离子的个数将酸分为一元酸、二元酸等,而不是含有氢原子的个数,例如CH3COOH中还有4个氢原子,但只电离子1个氢离子,为一元酸,故A错误;
B、HD是氢元素的同位素原子形成的单质,故B错误;
C、Na2O2不属于碱性氧化物,因为能和碱反应生成盐、水和氧气,故C错误;
D、蜡烛燃烧发光放热是化学变化;灯泡通电发光放热是物理变化.木炭燃烧放热是化学变化;浓硫酸稀释放热是物理变化,铁丝燃烧(固体由银白色变成黑色)是化学变化;氧气加压降温变成液态(有无色气体变成淡蓝色液体)是物理变化.二氧化碳和澄清石灰水反应生成沉淀碳酸钙是化学变化;把澄清石灰水加热出现沉淀是物理变化(氢氧化钙的溶解度随温度升高而减小).过氧化氢分解生成氧气是化学变化;水受热沸腾变成水蒸气是物理变化.故D正确;
故选D.
点评:本题考查了基本概念的应用,物质的分类原则,化学变化关键要看变化中是否有新物质生成.有新物质生成的是化学变化;没有新物质生成的是物理变化.
本题难度:困难
3、选择题 336mL某气体在标准状况下的质量为0.96g,该气体的摩尔质量约为:
A.64g
B.64
C.64g/mol
D.32g/mol
参考答案:C
本题解析:分析:根据M= =
= 计算其摩尔质量.
计算其摩尔质量.
解答:M= =
= =
= =64g/mol,
=64g/mol,
故选C.
点评:本题考查了摩尔质量的计算,注意公式的灵活运用是解本题的关键,难度不大.
本题难度:困难
4、选择题 用NA表示阿伏加德罗常数的值.下列叙述正确的是
A.1.2?g?NaHSO4晶体中阳离子和阴离子的总数为0.03?NA
B.100?mL?18.4?mol?L-1硫酸与足量铜反应,生成SO2的分子数为0.92?NA
C.1?L?1?mol?L-1的K2CO3溶液中离子总数小于3NA
D.室温下,42.0?g乙烯和丙烯的混合气体中含有的碳原子数为3NA
参考答案:D
本题解析:分析:A、质量换算物质的量,结合构成硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子计算判断;
B、浓硫酸与铜反应,随着反应进行浓度变稀,稀硫酸不与铜反应;
C、碳酸根离子水解阴离子增多;
D、乙烯和丙烯最简式相同,质量换算物质的量,计算42gCH2中的碳原子数即可;
解答:A、1.2 g NaHSO4晶体物质的量=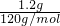 =0.01mol,硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子构成,阳离子和阴离子的总数为0.02 NA,故A错误;
=0.01mol,硫酸氢钠晶体的微粒是钠离子和硫酸氢根离子构成,阳离子和阴离子的总数为0.02 NA,故A错误;
B、浓硫酸与铜反应,随着反应进行浓度变稀,稀硫酸不与铜反应,生成SO2的分子数小于0.92 NA,故B错误;
C、碳酸根离子水解CO32-+H2O?HCO3-+OH-;阴离子数增多,所以1 L 1 mol?L-1的K2CO3溶液中离子总数大于3NA,故C错误;
D、乙烯和丙烯最简式相同,质量换算物质的量,计算42gCH2中的碳原子数即可;含有的碳原子数=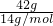 =3mol,即为3NA,故D正确;
=3mol,即为3NA,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,盐类水解的应用,关键是浓硫酸随反应进行浓度减小为稀硫酸后不再与铜反应.
本题难度:简单
5、选择题 下列有关溶液的说法中,正确的是
A.含H+的溶液显酸性,含OH-的溶液显碱性
B.用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D.标准状况下,2.24?L?NH3溶于水制得1L氨水,则c?(NH3?H2O)=0.1mol?L-1
参考答案:B
本题解析:分析:A.溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小;
B.胶体有丁达尔效应;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较;
D.NH3?H2O是弱电解质.
解答:A.判断溶液的酸碱性应根据溶液中氢离子浓度与氢氧根离子浓度的相对大小判断,故A错误;
B.溶液无丁达尔效应,胶体有丁达尔效应,可用丁达尔效应可以区别溶液与胶体,故B正确;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较大小,相同温度饱和溶液一定比不饱和溶液质量分数要大,故C错误;
D.NH3?H2O是弱电解质,能发生部分电离,浓度小于0.1mol?L-1,故D错误.
故选B.
点评:本题考查酸碱的定义、胶体的性质、饱和溶液、弱电解质的电离等,难度不大,注意溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小.
本题难度:一般