1、简答题 根据“三氟化硼→正三角形→非极性分子”的因果关系,则“三氯甲烷→(?①)→(?②)”的因果关系是 _______.
A、正四面体?B、非正四面体?C、非极性分子?D、极性分子?E、四边形
答案:①______;②______.
参考答案:由BF3的判断顺序可以看出结构→极性的关系.CH4和CCl4都是正四面体形结构,但CHCl3是氯和氢两种不同元素排在碳原子周围,它们的非金属性有差异,导致分子形成非正四面体,继而分子产生极性.
故答案为:B;D.
本题解析:
本题难度:一般
2、选择题 下列物质中既含有离子键,又含有非极性共价键的是
[? ]
A.NaOH
B.H2O
C.MgCl2
D.Na2O2
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列说法正确的是?
[? ]
A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构
B.第ⅠA族元素形成的单质的熔点随原子序数的递增而降低
C.共价化合物中一定不含有离子键
D.非金属元素组成的化合物一定是共价化合物?
参考答案:C
本题解析:
本题难度:一般
4、填空题 (14分)今有三种物质AC2、B2C2、AD4,元素A的最高正价和负化合价绝对值相等,元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;
元素D的负一阶阴离子电子层结构与氩原子相同,则:
(1)A、B、C、D的元素符号为A_______________、B_______________、C_______________、D_______________。
(2)AC2、B2C2、AD4的电子式分别为_______________、______________、______________。
(3)AC2的分子空间构型是_______________,属于_______________ (填“极性”或“非极性”)分子。AD4分子的空间构型是______________,属于_____________(填“极性”或“非极性”)分子。
(4)B2C2中既含有_______________键,又含有_______________键,属于_______________ (填“离子”或“共价”)化合物。
参考答案:(1)C;Na;O;Cl? (2)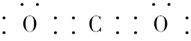 ;
;
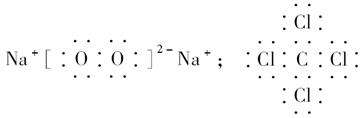 ? (3)直线形;非极性;正四面体形;非极性? (4)离子;非极性共价;离子
? (3)直线形;非极性;正四面体形;非极性? (4)离子;非极性共价;离子
本题解析:A的最高正价和负化合价绝对值相等,说明A为第四主族元素,B的焰色反应为黄色,说明B为钠,C为氧,则A可能是C或Si,但根据问题条件(2)、(3)可知,A为C,因为CO2才能写电子式、空间构型,才能谈分子的极性。与氩具有相同的电子层结构的微粒有K+、Ca2+、Cl-、S2-,所以D为氯。
本题难度:简单
5、选择题 下列指定微粒的个数比为2:1的是
[? ]
A.Be2+离子中的质子和电子
B.21H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
参考答案:A
本题解析:
本题难度:一般