1、填空题 (12分)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
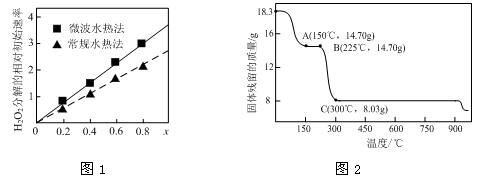
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
参考答案:(1)①+3 ②微波水热 Co2+
(2)① Co3O4(写成CoO·Co2O3亦给分) 3CoC2O4 + 2O2 = Co3O4 +6CO2
②由电子守恒:n(Co3+) =" 2" n(Cl2) =" 0.4" mol(1分)
由电荷守恒:n(Co)总=n(Co2+)溶液=" 0.5" n(Cl-) =" 0.5×(" 2.4mol-0.2mol×2)=" 1" mol
所以固体中的n(Co2+)= 1mol-0.4mol=" 0.6" mol(1分)
n(O)=(0.4mol×3+0.6mol×2)÷2=1.2mol(1分)
故n(Co):n(O)=1mol:1.2mol=5:6(1分)
(除第(1)②小题每空1分,第(2)②小题4分外,其余每空2分,共12分)
本题解析:(1)①该催化剂中Co、Ni均为+2价,O为-2价,所以Fe元素的化合价是[8-(2x+2-2x)]/2=+3;
②反应速率越快,则催化剂的催化活性越高,根据图像可知,x相同时微波水热法初始反应速率大于常规水热法,所以微波水热法制取得到的催化剂活性更高;随x增大,初始速率增大,而x增大,Co2+的比例增大,所以Co2+的催化效果更好;
(2)①由题意知,二水合草酸钴(CoC2O4·2H2O)的起始质量是18.3g,物质的量是0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量是8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g/mol=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1:0.133125=3:4,所以C点对应固体的化学式是Co3O4;B点对应的物质的质量是14.70g,与 起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与O2在225℃~300℃发生反应生成Co3O4和二氧化碳,所以反应的化学方程式是3CoC2O4 + 2O2 = Co3O4 +6CO2;
②设该钴的氧化物中+3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48L/22.4L/mol=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为+2价,则+3价Co得到电子的物质的量是x=0.4,480 mL 5 mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据Cl元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6mol,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4mol×3+0.6mol×2)/2=1.2mol,所以该钴氧化物中Co、O的物质的量之比为1.0:1.2=5:6.
考点:考查元素化合价的判断,物质化学式的计算,得失电子守恒规律的应用
本题难度:困难
2、实验题 分硫代硫酸钠与稀硫酸的反应为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)
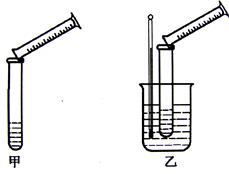
(1)实验目的:
装置甲,探究浓度对化学反应速率的影响;装置乙,探究 对化学反应速率的影响。
(2)装置乙中的加热方法称为 加热,该加热方法具有 、
等优点。
(3)通过甲、乙装置,分别进行了四组实验,数据记录如下,并经分析得出相关结论:
实验组号
| 温度
| Na2S2O3
| H2SO4
| 加入H2O
的体积
| 出现沉淀
所需时间
|
体积
| 浓度
| 体积
| 浓度
|
Ⅰ
| 0OC
| 5mL
| 0.1mol/L
| 10mL
| 0.1mol/L
| 5mL
| 8s
|
Ⅱ
| 0OC
| 5mL
| 0.1mol/L
| 5mL
| 0.1mol/L
| 10mL
| 12s
|
Ⅲ
| 30OC
| 5mL
| 0.1mol/L
| 5mL
| 0.1mol/L
| 10mL
| 4s
|
Ⅳ
| 30OC
| 5mL
| 0.2mol/L
| 5mL
| 0.2mol/L
| 10mL
| 2s
|
结论1: ;
结论2: 。
参考答案:(1)温度;
(2)水浴,均匀受热、易于控制温度;
(3)结论1:增大反应物浓度,反应速率加快;
结论2:升高温度,反应速率加快。
本题解析:(1)实验目的:装置乙使用了温度计,故探究温度对化学反应速率的影响。
(2)装置乙中的加热方法称为水浴加热,该加热方法具有均匀受热、易于控制温度等优点。
(3)通过甲、乙装置,分别进行了四组实验,数据记录如下,并经分析得出相关结论:甲是浓度问题,增大反应物浓度,反应速率加快;乙是温度问题,升高温度,反应速率加快。
考点:探究化学反应速率的影响因素实验。
本题难度:一般
3、选择题 某温度下,在固定容积的密闭容器内,可逆反应A(g)+3B(g) 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则(?)
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则(?)
A.平衡向正反应方向移动
B.平衡不发生移动
C.无法判断平衡移动方向
D.C的体积分数减小
参考答案:A
本题解析:以2∶2∶1的物质的量之比再充入A、B、C,相当于压缩体积为原来的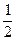 ,平衡向正反应方向移动。
,平衡向正反应方向移动。
本题难度:简单
4、选择题 已知:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) ΔH=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g) + 6H2O(g) ΔH=-1025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
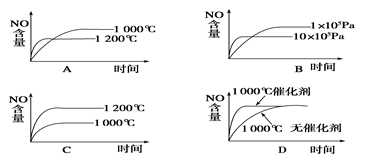
参考答案:C
本题解析:A、温度升高会加快反应速率,由于本反应是放热反应,所以升高温度会使平衡左移,正确;B、增大压强会加快反应速率同时使反应向减小体积的方向移动,正确;C、错误;D、催化剂会加快反应速率,但不影响平衡的移动,正确。
考点:考查影响化学平衡的条件。
本题难度:一般
5、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
[? ]
A.加入少量稀NaOH溶液?
B.加入少量CH3COONa固体
C.加入少量Na2SO4固体?
D.加入少量Na2CO3浓溶液
参考答案:D
本题解析:
本题难度:一般