1、实验题 实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
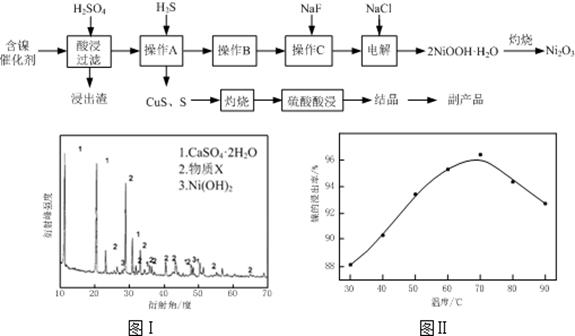
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为?。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是?。
(2)工艺流程中“副产品”的化学式为?。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Fe(OH)3
| Fe(OH)2
| Ni(OH)2
|
开始沉淀的pH
| 1.5
| 6.5
| 7.7
|
沉淀完全的pH
| 3.7
| 9.7
| 9.2
|
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价
?(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为?mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为?。
参考答案:(12分)(1)BaSO4?温度升高,Ni2+的水解程度增大
(2)CuSO4·5H2O
(3)方案错误。在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+
(4)3×10-6
(5)ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-
由题意知,含镍催化剂与硫酸反应后,Ca2+和Ba2+形成沉淀,通入硫化氢气体将Cu2+沉淀,操作B除去Fe3+,操作C除去Ca2+。最后加氯化钠电解硫酸镍溶液得到2NiOOH·H2O。
本题解析:(1)与硫酸反应产生沉淀的除硫酸钙、氢氧化镍外还有就是硫酸钡,所以物质X为BaSO4;由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大;
(2)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4?5H2O,
(3)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,而且pH为3.7~7.7,亚铁离子沉淀不完全,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+,
(4)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol?L-1,则Ca2+的浓度为2.7×10-11/(3×10-3)2= 3×10-6mol?L-1;
(5)Ni2+被ClO-氧化产生2NiOOH?H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,第②步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH?H2O+Cl-。
本题难度:一般
2、填空题 利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是?。
(2)验证炉渣中含有FeO必要的化学试剂为??。
(3)已知:生成氢氧化物沉淀的pH
物质
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
|
开始沉淀时
| 1.5
| 3.4
| 6.3
|
完全沉淀时
| 2.8
| 4.7
| 8.3
|
?
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是?。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是?。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是?。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是?。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是??。
参考答案:(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O (2分)
(2)稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液)(2分)
(3)①2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O (2分)
②pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。 (2分)
(4)ClO- + Cl- + 2H+ = Cl2 + H2O (2分)
(5)浓缩至饱和,冷却结晶(2分)
(6)2 : 3 (1分)
本题解析:(1)稀盐酸溶解Fe2O3:Fe2O3 + 6H+ = 2Fe3+ + 3H2O。
(2)验证FeO先要溶解,是盐酸,在证明Fe2+的检验,可用KMnO4溶液的褪色实验或K3[Fe(CN)6]溶液蓝色沉淀实验。
(3)①步骤Ⅱ中加入过量NaClO,将Fe2+氧化,2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。
(4)在步骤Ⅱ伴随着有氯气产生是因为:ClO- + Cl- + 2H+ = Cl2 + H2O。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是浓缩至饱和、冷却结晶。
(6)在步骤Ⅳ中发生反应,生成166 g Na2FeO4转移3 mol电子,3NaClO+4NaOH+2Fe(OH)3=2Na2FeO4+ 3NaCl + 5H2O。反应则参加反应的还原剂Fe(OH)3和氧化剂NaClO的物质的量之比是2:3。
本题难度:困难
3、选择题 在中学化学实验室经常用到下列实验装置,其中不可用于物质分离的装置是
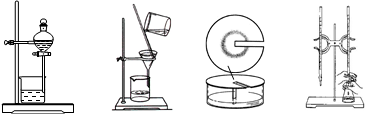
A.? B.? C.? D.
参考答案:D
本题解析: A、分液用于分离互不相容的液体,错误;B、过滤用于分离固液混合物,错误;C、纸上层析法用于分离在滤纸上移动速度不同的物质,错误;D、滴定用于测定未知液中某物质的浓度,正确。
本题难度:一般
4、选择题 在蒸馏实验中,下列叙述不正确的是
A.在蒸馏烧瓶中加入约1/3体积的自来水,并放入几粒碎瓷片
B.蒸馏结束时,先停止通冷却水,再熄灭酒精灯
C.冷水从冷凝管的下口入,上口出
D.收集冷凝水时,应弃去开始蒸馏出的部分
参考答案:B
本题解析:考查常见的基本实验操作。蒸馏结束时,先熄灭酒精灯,然后再停止通冷却水,选项B不正确,其余都是正确的,答案选B。
本题难度:简单
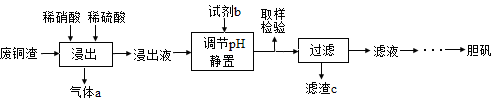
5、实验题 (12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
 ?
?
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:?。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是?。
(3)滤渣c是?。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、?。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:?。
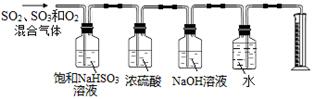
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:?。
参考答案:共12分。
(1)3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O(2分)
(2)向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净(2分)
(3)Fe(OH)3(2分)
(4)3NO2+H2O=2HNO3+NO(2分)
(5)3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
NaHSO3除了吸收SO3外和还吸收部分O2(合理答案均可)(2分)
本题解析:(1)根据氧化还原反应理论,铜与稀硫酸、稀硝酸的混合液反应生成硫酸铜、一氧化氮、水,化学方程式为3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O;
(2)Fe3+的检验方法是:向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)废铜渣中含有杂质铁,所以调节pH目的是使铁离子沉淀,则滤渣c是Fe(OH)3;
(4)气体a是NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水又得硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,配平方程式得3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
本题难度:一般