1、推断题 W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为__________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为______,将等体积、等浓度的W的最高价氧化物对应的水化物和Y的氢化物混合,已知在该混合溶液中c(H2Y)>c(Y2-),则剩余各离子浓度由大到小的顺序为____________。
(3)X的硝酸盐水溶液显______性,用离子方程式解释原因:____________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________。
(5)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是____________。
(6)Y与它的同族上一周期元素的氢化物的沸点____>____,稳定性____>____。(用化学式表示)
参考答案:(1)Al(OH)3+OH﹣=AlO2﹣+2H2O?
(2)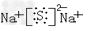 ;c(Na+)>c(HS-)>c(OH-)>c(H+)
;c(Na+)>c(HS-)>c(OH-)>c(H+)
(3)酸;Al3+ + 3H2O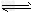 Al(OH)3 + 3H+
Al(OH)3 + 3H+
(4)Cl2+SO2+2H2O==H2SO4+2HCl?
(5)Al3+<Na+<Cl-<S2-?
(6)H2O>H2S;H2O> H2S
本题解析:
本题难度:一般
2、选择题 下列有关元素周期律的叙述中,正确的是
[? ]
A.氧化性强弱:F2<Cl2
B.金属性强弱:K<Na
C.酸性强弱:H3PO4<H2SO4
D.碱性强弱:NaOH<Mg(OH)2
参考答案:C
本题解析:
本题难度:一般
3、选择题 对于复分解反应:X+Y=Z+W,下列叙述正确的是?(?)
A.若Z是强酸,则X或Y必有一种是酸
B.若Y是强碱,X是盐,则Z或W必有一种是弱碱
C.若W是弱碱,Z是盐,则X或Y必有一种是强碱
D.若X是强酸,Y是盐,反应后可能有强酸或弱酸生成
参考答案:D
本题解析:略
本题难度:一般
4、简答题 下表是元素周期表的一部分.请用元素符号或化学式回答下列有关问题:
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
⑨
四
⑩
(11)
(12)
|
(1)在这些主族元素中,原子半径最大的 是______.
(2)上表中的单质,最活泼的金属元素是______,最活泼的非金属元素是______.
(3)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为______.
(4)③与④比较,化学性质较活泼的是______,证明的实验方法是______;证明⑧与(12)的单质活泼性强弱的离子方程式为______.
参考答案:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,(11)为Ca,(12)为Br,
(1)同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故上述元素中K的原子半径最大,故答案为:K;
(2)同周期随原子序数增大元素的金属性减弱、非金属性增强,同主族自上而下元素的金属性增强、非金属性减弱,故表中最活泼的金属元素是K,最活泼的非金属元素是F,故答案为:K;F;
(3)上述元素中,K的金属性最强,则KOH的碱性最强,氢氧化铝是两性氢氧化物,二者反应生成偏铝酸钾与水,反应离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,故答案为:OH-+Al(OH)3═AlO2-+2H2O;
(4)金属性Na>Mg,则Na的化学性质比Mg活泼,可以用金属与水(或酸)反应的难易程度、剧烈程度进行验证;氯气置换出溴单质,可以证明氯气比较溴活泼,反应离子方程式为:Cl2+2Br-═2Cl-+Br2,
故答案为:Na;与水(或酸)反应;Cl2+2Br-═2Cl-+Br2.
本题解析:
本题难度:一般
5、选择题 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,则下列推断不正确的是
A.A、B、E一定位于不同周期
B.A、D可能属于同一族
C.D位于第2周期
D.C和D的单质有可能化合形成离子化合物
参考答案:C
本题解析:B和E同主族,且原子序数B小于E,所以B在E的上一周期.D的半径比E大,所以D和E同周期,且在E的左边.C的半径比B小,所以C在B的右边.A的原子序数最小,原子半径最小,所以A在第1周期.
本题难度:一般