|
高考化学必考知识点《绿色化学》练习题(二)
2019-05-30 04:48:57
【 大 中 小】
|
1、填空题 水是生命之源,也是重要的环境要素之一。
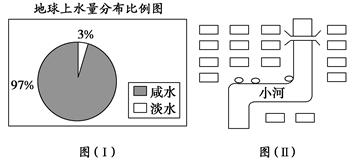
(1)观察下图(Ⅰ),若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是__________。
A.100 mL烧杯
B.50 mL烧杯
C.100 mL量筒
D.50 mL量筒
| 
(2)图(Ⅱ)是某居民小区中垃圾收集点(小圈)的布局,它在选址上存在的问题有________;垃圾收集点选址应考虑的因素包括__________________________
(3)有人设想在住宅小区附近建立小型生活垃圾焚烧厂,其流程如图(Ⅲ)。请将图(Ⅲ)中①②③所要表达的内容填在下面的横线上。
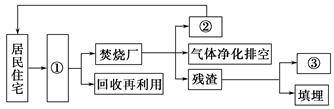
图(Ⅲ)
①______________________________;
②________________________________;
③_________________________________。
参考答案:(1)D、沿河放置污染水源 是否对小区景观产生影响,是否污染环境,是否便于运输等
(3)①垃圾分类收集点 ②热能 ③再利用(制砖、制肥料、作建筑填料)
本题解析:(1)淡水只占3%,只有0.03 L即30 mL,故选用50 mL量筒。(2)对河水造成污染的污染源之一是生活污水。图中生活垃圾场靠近小河,必定造成严重污染。(3)焚烧垃圾是一种常用的方法,但必须对废气严格处理。
本题难度:一般
2、选择题 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%;最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨。下列有关说法中错误的是
A.新的催化剂降低了反应所需要的能量
B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源
C.新法合成能在常温下进行是因为催化剂降低了反应的活化能
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
参考答案:D
本题解析:略
本题难度:简单
3、选择题 酸雨的主要成分是H2SO4,以下是形成途径之一:NO2+SO2→NO+SO3①,2NO+O2→2NO2②,SO3+H2O→H2SO4③
以下叙述错误的是?
A.NO2由反应N2+O2NO2生成
B.总反应可表示为2SO2+O2+2H2O2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O→4HNO3
D.还可能发生的反应有4NO+3O2+2H2O→4HNO3
参考答案:A
本题解析:分析:A.根据N2+O2 2NO; 2NO;
B.根据①×2+②+③×2;
C.根据3NO2+H2O═2HNO3+NO④以及④×2+②;
D.根据3NO2+H2O═2HNO3+NO④以及④×2+②×3;
解答:A.N2+O2 2NO,不能生成NO2,故A错误; 2NO,不能生成NO2,故A错误;
B.①×2+②+③×2得:2SO2+O2+2H2O═2H2SO4,故B正确;
C.利用3NO2+H2O═2HNO3+NO④以及④×2+②得:4NO2+O2+2H2O═4HNO3,故C正确;
D.利用3NO2+H2O═2HNO3+NO④以及④×2+②×3得:4NO+3O2+2H2O→4HNO3,故D正确;
故选:A.
点评:本题主要考查了方程式的书写,难度不大,根据课本知识即可完成.
本题难度:简单
4、选择题 下列物质的制备,符合工业生产实际的是
A.电解饱和氯化钠溶液制备金属钠
B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱
C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸
D.将SO2和O2的混合气加压后,通过接触室制备SO3
参考答案:B
本题解析:A、电解饱和氯化钠溶液,生成NaOH,错误;B、侯氏制碱法,正确;C、HCl直接用水吸收,错误;D、接触法制硫酸为常压下进行,错误。
本题难度:一般
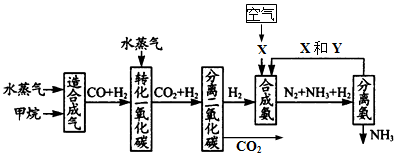
5、填空题 (17分) 重庆有丰富的天然气资源。以天然气为原料合成氨的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
请填写下列空白:
(1)已知2mol甲烷与水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是_______________________________。
(2)图中X为_____,Y为_____(填化学式);常用K2CO3溶液吸收分离出的CO2,其离子方程式为_____________________________________
(3)在合成氨工业中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来。请运用化学平衡的观点说明采取该措施的理由:_______________________________。
(4)联合制碱法中,合成氨产生的NH3与CO2通入饱和食盐水最终可制得纯碱,如图所示
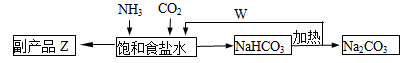
①应先向食盐水通足量_______气体(写化学式,后同);副产品Z为______,可用作______;W为_______。
②若生产 Na2CO3 5.3吨,理论上至少可制得副产品Z_______吨。
参考答案:(17分)
(1)CH4 (g) + H2O (g) ="==" CO(g) + 3H2(g)?△H =" +" 1/2a? kJ/mol? (3分)
(2)N2、? H2?(每空1分,共2分)
CO3- + CO2 + H2O? ="?" 2HCO3-?(3分)
(3)减小生成物浓度,促进平衡正向移动? (2分)
(4)①NH3;NH4Cl?氮肥;? CO2? (每空1分,共4分)?
② 5.35吨? (3分)
本题解析:略
本题难度:简单
| 
