?
参考答案:(1)4? XY2?(2)12
(3)109。28’? (4)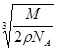 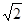 cm cm
(5)B、 C?(6)V形,正八面体,三角锥形,正四面体
本题解析::(1)X位于顶点,体心的Y吸引着4个X。每个X吸引着8个Y,如图所示:由于X粒子位于晶胞的顶点,只有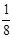 X属于该晶胞,而Y粒子位于晶胞内部,完全属于该晶胞,故该晶体中X∶Y=( X属于该晶胞,而Y粒子位于晶胞内部,完全属于该晶胞,故该晶体中X∶Y=(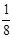 ×4)∶1,即化学式为XY2或Y2X。 ×4)∶1,即化学式为XY2或Y2X。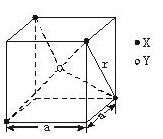
(2)每个X周围与X最接近且距离相等的X应为8×3×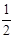 =12个。 =12个。
(3)由Y粒子和X粒子间虚线可知形成正四面体构型,所以∠XYX为109°28′
(4)设该晶胞的边长为a,两个X中心间距离为r,由于每个晶胞中相当于含有(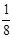 ×4)个X和一个Y,即 ×4)个X和一个Y,即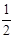 个XY2。则: 个XY2。则: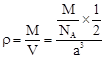 , ,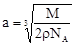 cm,又因为 cm,又因为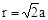 ,所以 ,所以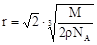 cm。 cm。
(5)氯化钠晶胞的配位数是6,所以选BC。
(6)H2S分子S有两对孤对电子和2个σ键,所以VSEPR构型是正四面体,分子构型是V形,SnCl62-离子中Sn没有孤对电子有6个σ键,所以VSEPR构型是正八面体,分子构型也是正八面体,PH3中P有一对孤对电子和3个σ键,所以VSEPR构型是正四面体,分子构型是三角锥,ClO4-中Cl没有孤对电子有4个σ键,所以VSEPR构型是正四面体,分子构型也是正四面体。
点评:通过晶体结构来计算化学式,键角和距离。VSEPR构型要除去孤对电子才是分子构型。
本题难度:一般
2、选择题 下列分子为直线形分子且分子中原子都满足8电子稳定结构( ? )
A.BeF2
B.C2H4
C.SO2
D.CO2
参考答案:D
本题解析:
本题难度:简单
3、计算题 (10分)已知金晶体是面心立方晶格(如下图所示)。金的原子半径为114 pm,试求金的
密度。(1 pm=10-10 cm)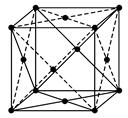
参考答案:ρ(Au)="19.39" g·cm-3
本题解析:在晶胞中每个晶格质点对该晶胞作出的贡献如下:
晶格质点类型
顶点
边
面心
体心
对一个单元晶胞的贡献
1/8
1/4
1/2
1
由上表知,在金晶体的每个晶胞中含有4个金原子,每个金晶胞的体积V(晶胞)=(144×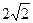 ?pm)3=6.757×107 pm3=6.757×10-23 cm3;每个晶胞的质量为m(晶胞)="197×4" g÷(6.02×1023)=1.31×10-21 g。所以ρ(Au)=1.31×10-21 g/(6.757×10-23 cm3)="19.39" g·cm-3 ?pm)3=6.757×107 pm3=6.757×10-23 cm3;每个晶胞的质量为m(晶胞)="197×4" g÷(6.02×1023)=1.31×10-21 g。所以ρ(Au)=1.31×10-21 g/(6.757×10-23 cm3)="19.39" g·cm-3
本题难度:一般
4、选择题 下列分子或离子的中心原子带有一对孤对电子的是
[? ]
A.HCl
B.BeCl2
C.CH4
D.PCl3
参考答案:D
本题解析:
本题难度:简单
5、填空题 金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数的值,M表示金的相对原子质量。
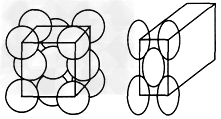
(1)金晶体每个晶胞中含有____个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____。
(3)一个晶胞的体积是多少?____________
(4)金晶体的密度是多少?____________
参考答案:(1)4?
(2)金原子间相接触?
(3)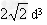
(4)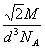
本题解析:
本题难度:一般
|