1、选择题 下列实验操作中错误的是(?)
A.进行蒸发操作时,当溶液中出现较多固体时即可停止加热
B.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
参考答案:D
本题解析:略
本题难度:简单
2、实验题 (1)如图为常见仪器的部分结构:
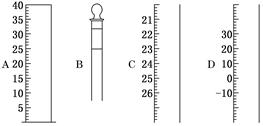
请写出仪器名称:
A________,B________,C________,D________。
(2)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体)________。
②容量瓶________。
③酸式滴定管________。
④集气瓶(收集HCl气体)________。
参考答案:(1)量筒 容量瓶 滴定管 温度计? (2)①用蒸馏水润湿 ②检查是否漏水
③检查是否漏水,活塞转动是否灵活 ④干燥
本题解析:考查常见仪器的识别及基本实验操作。
(1)根据仪器的构造及刻度线可知,四种仪器分别是量筒、容量瓶、滴定管、温度计。
(2)①用石蕊试纸检验气体的性质时,事先试纸应该湿润用蒸馏水润湿。
②使用容量瓶之前必需检查是否漏水。
③同样在使用酸式滴定管之前也必需检查是否漏水,以及活塞转动是否灵活等。
④干燥氯化氢极易溶于水,所以收集氯化氢的集气瓶必需时干燥的。
本题难度:简单
3、填空题 (12分)某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4?相对分子质量:98,质量分数:98%?密度:1.98 g/cm3。
甲同学认为,可以用一种精密仪器测量该溶液的 c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。
乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。
丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:(1)乙同学推测甲同学的方案不可行的理由是______________(1分)
(2)乙同学的方案的关键操作有两点:①确保SO完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,洗涤沉淀的操作方法是________________________________________;,
设计简单实验检验SO是否完全沉淀:_________________________________(2分)
(3)在丙同学的方案中步骤②用到的指示剂是________;达到滴定终点的标志是________________________________________________________________________。(2分)
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是________。(2分)
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
实验序号
| 硫酸体积
| NaOH溶液体积
| NaOH溶液浓度
|
①
| 5.00 mL
| 35.65 mL
| 5.00 mol·L-1
|
②
| 5.00 mL
| 39.65 mL
| 5.00 mol·L-1
|
③
| 5.00 mL
| 35.55 mL
| 5.00mol·L-1
|
通过计算,确认该浓硫酸质量分数与标签是否相符?________(填“相符”或“不相符”),理由(计算步骤)是______________________________________________________。(5分)
参考答案:(1)浓硫酸含水少,硫酸主要以分子形式存在
(2)通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止 在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO没有完全沉淀;若不产生白色沉淀,则说明SO已完全沉淀
(3)酚酞试液 无色变成粉红色,且半分钟内不褪色,(4)②④,(5)不相符 舍去误差大的数据(VNaOH=39.65 mL),可得==35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)= mol·L-1=19.8mol·L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=mol·L-1=17.8mol·L-1<19.8mol·L-1
本题解析:本题考查探究的基本方法,设计浓硫酸的性质,酸碱滴定的操作和计算,过滤、洗涤的基本操作。(1)因为浓硫酸含水少,极少数能电离出H+,主要以分子形式存在,故不能测定;
(2)通过玻璃棒引流,向过滤器中注入蒸馏水,浸没沉淀,待水流出后,再注入蒸馏水,重复多次直到沉淀洗净为止 在上层清液中滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明SO没有完全沉淀;若不产生白色沉淀,则说明SO已完全沉淀
(3)强酸强碱的滴定可以使用酚酞或者甲基橙;
(4)①中未润洗,导致NaOH浓度减小,消耗体积增大,测定结果偏高,②滴定前后都有气泡,气泡所占的体积不确定,故不能确定,③为正确操作,没有影响,④两次虽均仰视,但仰视的角度是否一样,同样不能确定,⑤滴定钱仰视,滴定后俯视,是体积偏小,测定浓度偏小,故答案为②④;
(5)不相符 舍去误差大的数据(VNaOH=39.65 mL),可得==35.60 mL,根据标签数据计算得浓硫酸的物质的量浓度为c(H2SO4)= mol·L-1=19.8mol·L-1,根据中和滴定测得浓硫酸的浓度为c(H2SO4)=mol·L-1=17.8mol·L-1<19.8mol·L-1
本题难度:一般
4、选择题 下列实验操作或对实验事实的叙述正确的是
①用稀盐酸洗涤盛放过石灰水的试剂瓶?②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;?③用pH试纸测得氯水的pH为2;?④用稀硝酸清洗做过银镜反应实验的试管;?⑤如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗;?⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;?⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;?⑧向某溶液加入NaOH浓溶液并加热能产生能使湿润的红色石蕊试纸变蓝 的气体,则原溶液中含NH4+
的气体,则原溶液中含NH4+
A.①⑤⑦
B.③④⑦⑧
C.②③⑤⑥
D.①②④⑧
参考答案:D
本题解析:略
本题难度:一般
5、选择题 关于下列各装置的叙述中,错误的是

A.装置①可用于探究NH4HCO3的热稳定性
B.装置②可用于收集H2、CO2
C.装置③中X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的氨气
参考答案:A
本题解析:A、错误,因为分解的产物中有氨气易产生倒吸;B、正确,收集密度小的氢气,短进长出,用向下排空气法,收集密度大的二氧化碳,长进短出,用向上排空气法;C、正确,因氨气、氯化氢难溶于四氯化碳易溶于水,因而能起到防倒吸的作用;D、正确,考虑到氨气的干燥、收集、吸收均正确。
本题难度:一般