|
高考化学知识点总结《难溶电解质的溶解平衡》高频试题强化练习(2019年最新版)(十)
2019-05-30 05:00:19
【 大 中 小】
|
1、选择题 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)

Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
A.加入NaCl可以使溶液由a点变到b点
B.b点和d点均无AgCl沉淀生成
C.a点对应的Ksp大于c点对应的Ksp
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)

Ag2S(s)+2Cl-(aq)
| 
参考答案:A.加入NaCl,Cl-浓度增大,Ag+浓度减小,而a点与b点Cl-浓度相同,故A错误;
B.b点c(Ag+)?c(Cl-)>Ksp,有沉淀生成,d点c(Ag+)?c(Cl-)<Ksp,没有沉淀生成,故B错误;
C.a点和c点处于相同温度下,Ksp相同,故C错误;
D.Ag2S溶度积较小,较AgCl难溶,在AgCl饱和溶液中加入Na2S溶液,白色沉淀转化为黑色沉淀,故D正确.
故选D.
本题解析:
本题难度:一般
2、计算题 在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?(必须写出判断理由)(已知:Ksp(ZnS)=1.6×10-24mol2/L2?Ksp(CuS)=1.3×10-36mol2/L2)
参考答案:[S2-]=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
Q=[Cu2+]×[S2-]=0.001mol/L×1.61/2×10-12mol/L=1.61/2×10-15mol2/L2>Ksp(CuS)
所以有CuS沉淀产生。
本题解析:ZnS(s) Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-), Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-),
c(S2-)=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
CuS(s) Cu2+(aq)+S2-(aq),Q=c(Cu2+)c(S2-)=0.001×1.61/2×10-12=1.26×10-15>Ksp,故有沉淀生成。 Cu2+(aq)+S2-(aq),Q=c(Cu2+)c(S2-)=0.001×1.61/2×10-12=1.26×10-15>Ksp,故有沉淀生成。
本题难度:一般
3、推断题 甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知:
(1)A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟;
(2)各物质之间存在如下图所示的转化关系
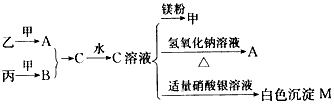
请回答下列问题:
(1)C溶液显_______性(填“酸”“碱”或“中”),若A溶液的物质的量浓度是B溶液的物质的量浓度的2倍,且等体积混合后溶液中各离子浓度由大到小的顺序为__________________(用离子符号表示)。
(2)一定条件下,乙气体与甲气体充分反应生成6.8 g A气体,可放出18. 44 kJ 热量,则该反应的热化学方程式为__________________。
(3)在一定温度下,向容积不变(容积为10 L)的密闭容器中加入2 mol乙气体、 8mol甲气体及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为
________,反应达平衡状态时甲气体的转化率为_______,若想提高A的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条);在上述平衡中,若再加入2 mol A气体、2 mol乙气体,则此时化学平衡将____(填“向正方向”“向逆方向”或 “不”)移动。
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将_________ (填“增大”“减小”或“不变”),Ksp(M)将________(填“增大”“减小”或“不变”)。
参考答案:(1)酸;c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(2)N2(g)+3H2(g)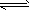 2NH3(g) △H=-92.2 kJ/mol 2NH3(g) △H=-92.2 kJ/mol
(3)0. 01 mol/(L·min);37. 5%;增大氢气浓度或增大氮气浓度或增大反应物的浓度或及时移出氨气或增大压强或降温(其他合理答案均可);向逆方向?
(4)减小;不变
本题解析:
本题难度:一般
4、填空题 工业上制备BaCl2的工艺流程图如下
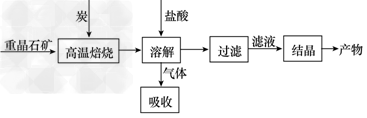
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ① 4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ② 2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为__________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________。 =________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) 2CO(g)的ΔH3=____kJ/mol。 2CO(g)的ΔH3=____kJ/mol。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是__________________________________________________。
参考答案:(1)S2-+H2O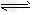 HS-+OH-、HS-+H2O HS-+OH-、HS-+H2O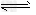 H2S+OH- H2S+OH-
(2)2.7×10-3
(3)172.5
(4)使BaSO4得到充分还原(或提高BaS的产量);①②为吸热反应,炭和氧气反应放热可维持反应所需高温
本题解析:
本题难度:一般
5、选择题 化学教科书中有大量的数据,下列为某同学对数据的利用情况,其中不正确的是( )
A.用溶解度数据判断长时间煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3
B.用沸点数据推测一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用原子(或离子)半径数据推测某些原子(或离子)氧化性或还原性的强弱
参考答案:A、Mg(HCO3)2加热时易分解,一般情况下生成MgCO3,但在解热时分解生成Mg(OH)2沉淀,说明Mg(OH)2比MgCO3溶解度更小,故A正确;
B、根据沸点的大小,如沸点相差较大,液体混合物可用蒸馏的方法进行分离,故B正确;
C、反应热的大小取决于反应物与生成物的总能量大小关系,反应速率与物质的自身性质以及外界条件有关,不能用反应热数据的大小判断不同反应的反应速率的快慢,但可用来比较相似反应的快慢,故C错误;
D、原子(或离子)半径越大,原子核对最外层电子的吸引力越小,原子(或离子)越易失去电子,还原性越强,则离子的氧化性越弱,故D正确.
故选C.
本题解析:
本题难度:一般
| 