1、选择题 在某温度下,可逆反应mA+nB  ?pC+qD在平衡常数为K,下列说法正确的是
?pC+qD在平衡常数为K,下列说法正确的是
A.K越大,达到平衡时,反应进行的程度越大
B.K越大,达到平衡时,C的浓度越小
C.C的起始浓度越大,K值越大
D.K随温度的改变而改变
参考答案:A
本题解析:平衡常数是指在一定条件下,反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值是平衡常数。平衡常数越大,反应进行的程度越大,A正确,B不正确。平衡常数和温度及化学计量数有关系,所以CD不正确。答案选A。
本题难度:简单
2、选择题 下列对熵的理解不正确的是?(?)
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25℃、1.01ⅹ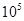 Pa时,2N2O5(g)
Pa时,2N2O5(g)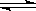 4NO2(g)+O2(g)是熵增的反应
4NO2(g)+O2(g)是熵增的反应
参考答案:C
本题解析:与外界隔离的体系,自发过程将导致体系的熵增大,故C错误
本题难度:简单
3、选择题 恒温下,下列物质的状态变化中,△S变化最大的是(?)
A.H2O(l)=H2O(g)
B.H2O(s)=H2O(g)
C.H2O(s)=H2O(l)
D.H2O(l)=H2O(s)
参考答案:B
本题解析:同一种物质的熵值为气态对于液态,液态大于气态,所以对于水的状态的变化,△S变化最大的是H2O(s)=H2O(g),故本题的答案为B。
点评:本题考查了对物质熵值变化的判断,该考点是高考考查的常考考点,本题要掌握的是同一种物质的熵值为气态对于液态,液态大于气态,本题难度不大。
本题难度:一般
4、选择题 对于化学反应方向的确定,下列说法正确的是( )
A.在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压力一定时,放热的熵增加反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程与焓变有关
参考答案:A、在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向,△H-T△S<0,则能自发进行;△H-T△S>0,则不能自发进行;故A错误;
B、温度、压力一定时,放热的熵增加反应,△H<0,△S>0,△H-T△S<0,反应一定能自发进行,故B正确;
C、反应自发进行由焓变、熵变、温度共同决定,故C错误;
D、固体溶解主要是物理过程,焓变是反应前后的能量变化;故D错误;
故选AB.
本题解析:
本题难度:一般
5、选择题 相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:
2XY2(g)+Y2(g)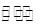 2XY3(g),?
2XY3(g),?
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
| 起始时各物质物质的量/mol
| 达平衡时体系能量的变化
|
编号
| XY2
| Y2
| XY3
|
①
| 2
| 1
| 0
| 放热0.25QkJ
|
②
| 1.2
| 0.6
| 0.8
| ?
|
下列叙述不正确的是
A.达到平衡时,①和②两容器中气体的平均相对分子质量相同
B.容器②中反应达到平衡时放出的热量为0.15 Q kJ
C.达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol·L-1
D.若容器①的其他条件不变,只增加1mol稀有气体,则达到平衡时放出的热量等于0.25 Q kJ
参考答案:B
本题解析:由容器①放热量可知,平衡时各物质消耗量(生成量)为:XY2:0.5mol, Y:0.25mol, XY3:0.5mol,剩余量为:XY2:1.5mol, Y:0.75mol, XY3:0.5mol,则平衡时浓度为:XY2:3mol/L, Y:1.5mol/L, XY3:1mol/L,K值为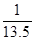 。C描述正确,不选。
。C描述正确,不选。
从起始时各物质物质的量可知,两容器达到平衡时是等效平衡,平衡时各物质浓度相同,所以A描述正确,不选。
又由两容器为等效平衡,容器②若要达到平衡,则需要生成0.3molXY2和0.15molY,平衡前反应逆向进行程度更大,达到平衡需吸收热量,B错误。
若容器①其他条件不变,充入稀有气体,虽然会增大压强,但是此压强变化不会影响各反应物浓度,对反应平衡没有任何影响,D描述正确,不选。
本题难度:一般